根据观研报告网发布的《2022年中国疫苗行业分析报告-行业格局现状与投资战略研究》显示,疫苗是指用各类病原微生物制作的用于预防接种的生物制品,分为活疫苗和死疫苗两种。常用的活疫苗有卡介苗,脊髓灰质炎疫苗、麻疹疫苗、鼠疫菌苗等。常用的死疫苗有百日咳菌苗、伤寒菌苗、流脑菌苗、霍乱菌苗等。
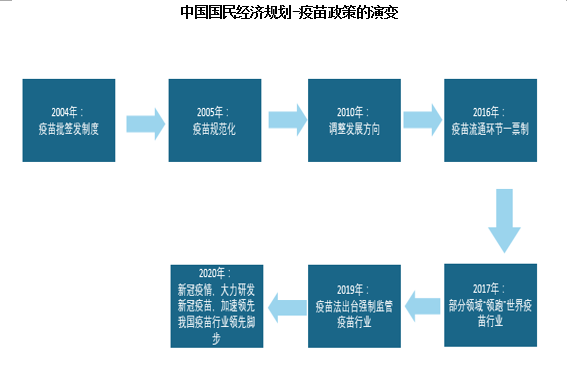
由于疫苗直接用于健康人群,直接影响公共卫生安全和人民健康,是公共卫生和生物医药的重要组成部分。近年来我国对疫苗行业的支持政策从“要求规范化”到“出台法律”再到“攻克技术引领行业”的变化;在疫苗研发、产品注册、生产、生产检验、流通、异常反应处理等方面都制定了一系列的法律法规,以加强对疫苗行业的监管。例如在在2020年12月11日,国家市监局就公布了《生物制品批签发管理办法》,进一步完善了生物制品批签发机构确定、批签发申请与审核检验等管理举措。而随着2021年3月1日,该《办法》的正式实施,我国生物制品批签发工作进入已进入更规范的阶段,未来发展空间将更为可观。
资料来源:观研天下整理
近年来我国疫苗行业相关政策
|
颁布时间 |
政策名称 |
部门 |
主要内容 |
|
2008年03月 |
《国家中长期科学和技术发展规划纲要(2006-2020年)》 |
国务院 |
指出“生物技术和生命科学将成为21世纪引发新科技革命的重要推动力量”,“把生物技术作为未来高技术产业迎头赶上的重点,加强生物技术在农业、工业、人口与健康等领域的应用”,并提出重点研究“用于应对突发生物事件的疫苗及免疫佐剂、抗毒素与药物等”。 |
|
2007年12月 |
《扩大国家免疫规划实施方案》 |
卫生部 |
将计划免疫品种从原来可预防7类疾病的6种疫苗,增加到可预防15类疾病的14种疫苗。 |
|
2009年06月 |
《促进生物产业加快发展的若干政策》 |
国务院 |
提出“加快培育生物产业,是我国在新世纪国务院把握新科技革命战略机遇、全面建设创新型国家的重大举措;并将生物医药领域作为现代生物产业发展的重点领域”,且提出“重点发展预防和诊断严重威胁我国人民群众生命健康的重大传染病的新型疫苗和诊断试剂”。 |
|
2010年10月 |
《关于加快培育和发展战略性新兴产业的决定》 |
国务院 |
提出“大力发展用于重大疾病防治的生物技术药物、新型疫苗和诊断试剂、化学药物、现代中药等创新药物大品种,提升生物药业产业水平”。 |
|
2011年12月 |
《疫苗供应体系建设规划》 |
国务院 |
提出“到2015年,初步建成满足我国经济社会发展需要的疫苗供应体系;到2020年,我国疫苗供应体系进一步健全完善,具备与发达国家同步应对突发和重大疫情的实力”,并具体提出“(一) 加强法规和标准体系建设;(二)加大财政等政策支持力度;(三)加大科研经费投入;(四)加强人才培养;(五)加强疫苗供应体系建设的协调”5点措施。 |
|
2012年12月 |
《生物产业发展规划》 |
国务院 |
明确我国生物产业的发展目标为“到2020年,生物产业发展成为国民经济的支柱产业”,并提出“大力开展生物技术药物创新和产业化。促进疫苗升级换代,重点推动新型疫苗(包括治疗性疫苗)研发和产业化”。 |
|
2015年05月 |
《中国制造2025》 |
国务院 |
明确将新型疫苗所在的“生物医药及高性能医疗器械”领域列为“大力推动重点领域突破发展”中的一部分。 |
|
2016年12月 |
《“十三五”国家战略性新兴产业发展规划》 |
国务院 |
提出“建立生物医药新体系,加快开发具有重大临床需求的创新药物和生物制品,加快推广绿色化、智能化制药生产技术,强化科学高效监管和政策支持,推动产业国际化发展,加快建设生物医药强国”。 |
|
2016年12月 |
《“十三五”生物产业发展规划》 |
发改委 |
明确我国生物产业的发展目标“到2020年,生物产业规模达到8-10万亿元,生物产业增加值占GDP 的比重超过 4%,成为国民经济的主导产业”,并提出“发展治疗性疫苗,开发安全、高效的活载体基因工程多价疫苗,创新一批新型动物疫苗”。 |
|
2017年2月 |
《关于进一步加强疫苗流通和预防接种管理工作的意见》 |
中共中央国务院 |
部署加强疫苗流通和预防接种管理工作,从完善机制、促进研发、加强管理、强化监督等方面提出具体要求。 |
|
2017年4月 |
《“十三五”生物技术创新专项计划》 |
中华人民共和国科学技术部 |
重点突破新型疫苗、抗体制备、免疫治疗等关健技术,抢占生物医药产业战略制高点,力争到2020年实现我国生物医药整体由"跟跑*到"并跑"、部分领域"领跑”的转变。 |
|
2017年12月 |
《疫苗储存和运输管理规范》 |
卫生部、国家食品药品监督管理局. |
加强疫苗储存、运输管理,保证疫苗质量,保障预防接种的安全性和有效性。 |
|
2018年2月 |
《生物制品批签发管理办法》 |
国家市场监督管理总局 |
每批制品出厂销售前或者进口时实行强制性审查、检验和批准。 |
|
2019年3月 |
《中华人民共和国药品管理法实施条例》 |
国家要药品监督管理总局 |
根据药品管理法,进一步明确对药品生产和经营企业、药品的管理和监督。. |
|
2019年4月 |
《国务院办公厅关于同意建立疫苗管理部际联席会议制度的图》 |
中共中央国务院 |
为加强部门间协调配合,进一步提升疫苗管理能力水平,形成权责清晰、运行高效的疫苗管理体系,经由国务院同意,市场监管总局、国家卫生健康委、国家药监局牵头,建立疫苗管理部际联席会议。 |
|
2019年12月 |
《预防用疫苗临床可比性研究技术指导原则》 |
国家要药品监督管理总局 |
进一步规范和提高疫苗临床研发水平,落实国家关于加强疫苗质量安全监督工作的要求,明确和统一临床技术标准,保证同类疫苗注册上市时具有相似的安全性和有效性,指导非创新疫苗的临床研究和评价。 |
|
2020年3月 |
《关于印发因新型冠状病毒肺炎疫情防控疫苗迟种补种技术方案的通知》 |
国家发改委 |
受疫情影响,很多疫苗接种被耽搁了约2个月,中国疾病预防控制中心下发通知,建议优先补种免疫规划疫苗,传染性强、危害性大的疾病的疫苗。 |
|
2020年5月 |
《疫苗生产流通管理规定(征求意见稿)》 |
国家药监局 |
国家药监局组织起草了该意见。目的在于构建科学、有效的疫苗生产流通监督管理体系,依法对疫苗的生产、流通管理活动进行规范。. |
|
2020年10月 |
《疫苗责任强制保险管理办法(征求意见稿)》 |
国家药监局 |
明确规定疫苗上市许可持有人均应投保,明确了疫苗上市许可持有人由于疫苗的质量问题对于接种者造成伤害时应该担负的赔偿责任,同时还具体规定了需要投保的强制责任保险类型,进一步保障接种者的人身安全。. |
|
2021年3月 |
《国家免疫规划疫苗儿童免疫程序及说明(2021年版)》 |
国家卫生健康委 |
新版程序及说明主要有两大变化,一是优化调整部分接种程序和剂型,二是对长期困扰基层医疗工作者、临床医生和家长的常见特殊健康状态儿童接种问题进行了说明。 |
资料来源:观研天下整理
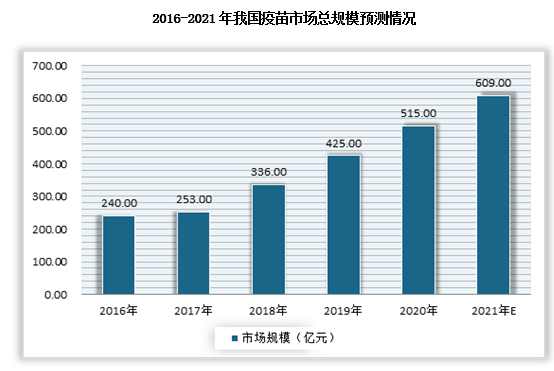
近年来,受益于政策利好、人口基数庞大、疫苗品种的不断丰富与可及性的持续提升以及群众接种疫苗意识的增强,我国疫苗市场未来仍将继续保持快速增长态势。尤其是进入2020年,受新冠疫情影响,市场进一步扩大。根据数据显示,2020年我国疫苗市场总规模达到了515亿元,预计到2021年将突破600亿元。
数据来源:中检所
2013-2019年期间我国疫苗批签发量整体呈波动态势。但进入2020年,在新冠肺炎疫情下,疫苗批签发量明显增长。根据数据显示,2020年我国疫苗批签发量为6.5亿支,同比增长15%;截止到2021年4月批签发疫苗1.54亿支。
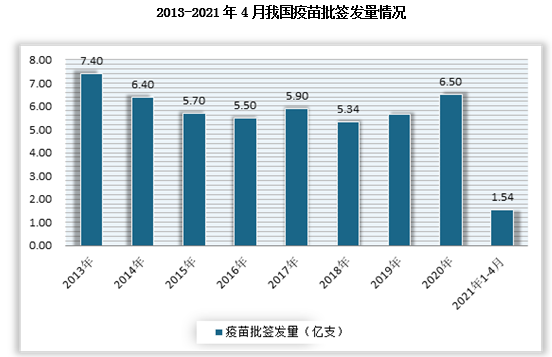
数据来源:中检所
从细分产品来看,目前我国疫苗行业主要集中在肺炎疫苗、狂犬病疫苗、流感疫苗、HPV疫苗以及新冠疫苗。
具体来看,2020年受新冠肺炎疫情影响,在肺炎疫苗、狂犬病疫苗、流感疫苗、HPV疫苗均迎来大增。数据显示,2020年肺炎疫苗批签发量为2838万支;其中13价肺炎结合疫苗批签发量为1089万支,23价肺炎多糖疫苗批签发量为1739万支。
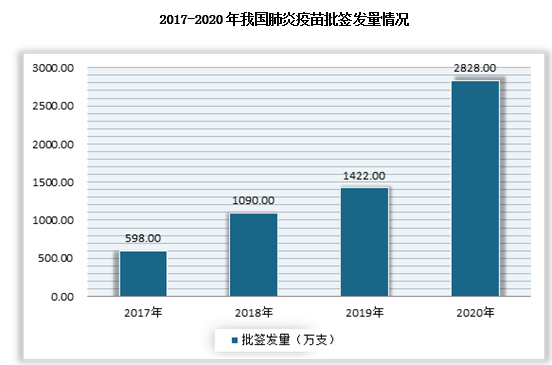
数据来源:中检所
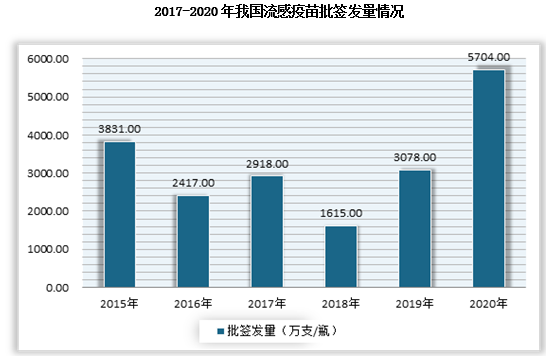
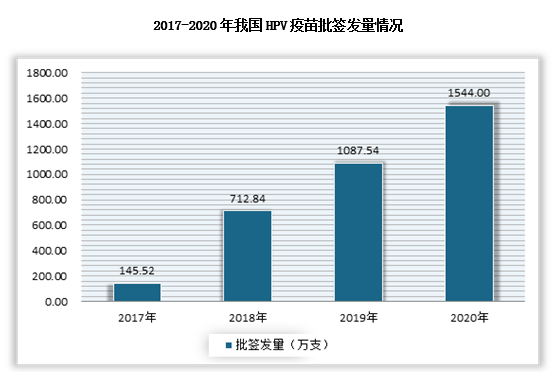
2020年我国人用狂犬病疫苗批签发量为7860万支,同比增长33.6%;流感疫苗批签发量为5704万支/瓶,同比增长85.3;HPV疫苗为1544万支。

数据来源:中检所
数据来源:中检所
数据来源:中检所
新冠疫苗方面,自新冠疫苗上市以来,国家疫苗接种有序推进。截至2021年8月26日,全国累计报告接种新冠病毒疫苗200391.4万剂次,完成全程接种的人数为88943.9万人。
另一方面,新冠疫苗研发也在有序推进,目前中国与美国新冠疫苗研发进展领先全球。据了解,国内厂商主要是武汉所、北京所、科兴生物、康希诺、昆明所、康泰生物、智飞生物、沃森生物、康泰生物等。其中武汉所、北京所、科兴生物、康希诺、康泰生物、智飞生物、沃森生物的临床试验进度已进入到3期,此外康泰生物即将开展桥接试验。
全球进度领先的新冠疫苗临床研究进度梳理
|
技术路线 |
开发者 |
新药申请 |
临床试验进度明细 |
进度预估 |
|
|
mRNA |
BioNTech/复星医药/Pfize |
多国EUA |
Phase 1→Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
mRNA |
Moderna/NIAID |
多国EUA |
Phase 1→Phase 2→Phase 3 |
继续开展3期临床 |
|
|
非复制型腺病毒载体 |
牛津大学/阿斯利康 |
多国EUA |
Phase 1/2→Phase 2→Phase3 |
继续开展3期临床 |
|
|
灭活 |
中国生物/北京所 |
多国EUA |
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
灭活 |
中国生物/武汉所 |
多国EUA |
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
灭活 |
科兴生物 |
多国EUA |
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
非复制型腺病毒载体 |
Gamaleya研究所 |
多国EUA |
Phase 1/2→Phase 2→Phase 3 |
继续开展3期临床 |
|
|
非复制型腺病毒载体 |
康希诺/军科院 |
多国EUA |
Phase 1→Phase 2→Phase 3 |
继续开展3期临床 |
|
|
非复制型腺病毒载体 |
Janssen |
美国EUA |
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
重组蛋白亚单位 |
Novavax |
|
Phase 1/2→Phase 2b→Phase 3 |
继续开展3期临床 |
|
|
重组蛋白亚单位 |
智飞生物 |
多国EUA |
Phase 1→Phase 2→Phase 3 |
继续开展3期临床,Q3发布期中分析数据 |
|
|
mRNA |
Curevac |
- |
Phase 1→Phase 2→Phase 3 |
继续开展3期临床 |
|
|
灭活 |
中国医科院生物所 |
|
Phase 1→Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
VLP |
Medicago |
|
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
DNA |
Cadila healthcare |
|
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
灭活 |
Bharat biotech |
印度EUA |
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
灭活 |
哈萨克斯坦生物安全研究所 |
|
Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
灭活 |
康泰生物(北京民海) |
|
Phase 1→Phase 1/2→Phase 3 |
继续开展3期临床 |
|
|
mRNA |
沃森生物/艾博生物/军科院 |
|
Phase 1→Phase 2→Phase 3 |
继续开展3期临床 |
|
|
非复制型腺病毒载体 |
阿斯利康/康泰生物 |
|
桥接实验 |
即将开展桥接临床实验 |
资料来源:观研天下整理
国内新冠疫苗主要厂商核心要素梳理(截至2021年2月3日)
|
技术路线 |
单位 |
生产难点 |
生产体系建设成本 |
生产体系建设周期 |
生产体系建设进度 |
设计产能(年) |
临床试验进度 |
|
灭活 |
武汉所 |
P3等级操作及分离纯化 |
1亿剂次生产体系对应10亿元 |
6个月左右 |
一期已建成二期在扩产 |
30亿 |
3期 |
|
灭活 |
北京所 |
||||||
|
灭活 |
科兴生物 |
P3等级操作及分离纯化 |
1亿剂次生产体系对应10亿元 |
6个月左右 |
一期已建成二期在扩产 |
20亿 |
3期 |
|
腺病毒 |
康希诺 |
腺病毒大规模发酵培养 |
5.75亿元(二期) |
4个月 |
建设中 |
5-7亿 |
3期 |
|
灭活 |
昆明所 |
P3等级操作及分离纯化 |
- |
- |
- |
5-10亿 |
2期 |
|
灭活 |
康泰生物 |
P3等级操作及分离纯化 |
10亿元 |
6个月左右 |
第二条线建设中 |
2-6亿 |
3期 |
|
亚单位 |
智飞生物 |
- |
- |
6个月左右 |
已建成在扩产 |
6亿 |
3期 |
|
mRNA |
沃森生物 |
LNP脂质体包被 |
- |
8个月内 |
一期建设中 |
2亿 |
3期 |
|
腺病毒 |
康泰生物 |
腺病毒大规模发酵培养 |
10亿元 |
6个月左右 |
已建成 |
2-4亿 |
即将开展桥接试验 |
资料来源:观研天下整理
目前全球大部分新冠疫苗产能流向高收入国家,中低收入国家和COVAX等组织可用份额较少。有数据显示,截至2021年7月30日,高收入国家已确认65亿剂,中等偏高收入国家为24亿剂,中低收入国家为31亿剂,低收入国家为3.3亿剂,COVAX等组织32.4亿剂;
虽然目前我国疫苗行业有着庞大的市场,但与国外如美国等相比,疫苗行业的发展还具有巨大的发展空间。预计在民众疫苗使用安全意识的增强、国内疫苗产品研发和生产水平的提高以及相关有利政策等因素的促进下,我国疫苗产业发展仍存在巨大潜力。同时随着新型疫苗的需求日益增加,市场进一步扩大。总的来看,在我国疫苗产业进入高速发展的阶段,制药设备也将迎来更多机遇。

资料来源:观研天下整理(WW)
行业分析报告是决策者了解行业信息、掌握行业现状、判断行业趋势的重要参考依据。随着国内外经济形势调整,未来我国各行业的发展都将进入新阶段,决策和判断也需要更加谨慎。在信息时代中谁掌握更多的行业信息,谁将在未来竞争和发展中处于更有利的位置。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。