1.政策+需求驱动体外诊断试剂发展
体外诊断试剂是可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。体外诊断试剂与体外诊断仪器构成体外诊断产业,体外诊断产业一直是国内重点支持的产业之一。根据观研报告网发布的《中国体外诊断试剂行业发展深度研究与投资前景分析报告(2022-2029年)》显示,从2005年起,国务院、发改委、科技部等多个国家部门出台了多个政策,对于促进体外诊断试剂、诊断仪器、诊断相关酶制剂等体外诊断产业的发展具有积极的意义。同时,基层医院随着新医改和关注民生的深入为体外诊断行业带来了巨大的增量市场。数据显示,我国体外诊断行业市场规模由2016年的450亿元增长至2021年的1243亿元,预计2022年我国体外诊断行业市场规模将达到1460亿元。
我国体外诊断试剂相关政策
| 时间 | 政策 | 主要内容 |
| 2021.08 | 《体外诊断试剂注册与备案管理办法》 | 规范体外诊断试剂注册与备案行为,保证体外诊断试剂的安全、有效和质量可控 |
| 2021.05 | 《体外诊断试剂温控物流服务规范》 | 规定了体外诊断试剂物流过程中的收货、验收、贮存、在库检查、发货、运输、温度监测和控制 |
| 2021.03 | 《医疗器械监督管理条例》(国令第739号) | 规定了医疗器械产品注册与备案、医疗器械生产、医疗器械经营与使用、不良事件的处理与器械的召回 |
| 2020.11 | 《中共中央关于制定国民经济和社会发展第十四个五年规划二O三五年远景目标的建议》 | 加快壮大生物技术等战略性新兴产业,强化生物安全保护。 |
| 2020.03 | 《关于完善发热门诊和医疗机构感染防控工作的通知》 | 进一步规范发热门诊建设和管理,从发热门诊位置、分区设置、设备配备、人员配置、管理等方面提出要求。 |
| 2020.05 | 《2020年政府工作报告》 | 用好抗疫特别国债,加大疫菌、药物和快速检测技术研发投入,增加防疫救治医疗设施,增加移动实验室,强化应急物资保障,强化基层卫生防疫。 |
| 2019.03 | 《2019年政府工作报告》 | 要实施癌症防治行动,推进预防筛查、早诊早治和科研攻关,着力缓解民生的痛点。 |
| 2017.05 | 《“十三五”医疗器械科技创新专项规划》 | 体外诊断领域前沿性技术:以“--体化、高通量、现场化、高精度”为方向,围绕临检自动化、快速精准检测、病理智能诊断、疾病早期诊断等难点问题,加快发展微流控芯片等前沿技术。 |
| 2017.04 | 《“十三五”生物技术创新专项规划》 | 加快发展新型生物医用材料、体外诊断技术与产品、家庭医疗监测和健康装备、可穿戴设备、基层适宜的诊疗设备、移动医疗等产品。 |
| 2016.12 | 《“十三五”生物产业发展规划》 | 要加速现场快速检测的体外诊断仪器、试剂和试纸的研发和产业化。针对糖尿病、高尿酸血症、高脂血症等慢性病,加快便捷和准确的家用体外诊断产品的产业化。加快特异性高的分子诊断、生物芯片等新技术发展,支撑肿瘤、遗传疾病、罕见病等疾病的体外快速准确诊断筛查。 |
| 2016.11 | 《“十三五”国家战略性新兴产业发展规划》 | 加速发展体外诊断仪器、设备、试剂等新产品,推动高特异性分子诊断、生物芯片等新技术发展,支撑肿瘤、遗传疾病及罕见病等体外快速准确诊断筛查。 |
| 2016.01 | 《医药工业发展规划指南》 | 重点发展高通量生化分析仪、免疫分析仪,新型即时检测设备(POCT)。加强体外诊断设备、检测试剂、信息化管理软件和數据分析系统的整合创新,加快检测试剂标准建立、溯源用标准物质研制和新试剂开发。 |
资料来源:观研天下整理
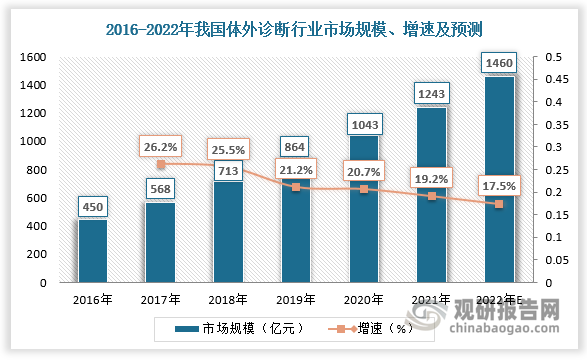
数据来源:观研天下数据中心整理
2.免疫诊断试剂为主流,新冠检测需求推动POCT试剂规模增长
按检验原理,体外诊断试剂可分为生化诊断、免疫诊断、分子诊断、血液诊断、微生物诊断和即时检测(POCT)。具有灵敏性、精确度高等特点的免疫诊断是IVD行业市场占比最大的细分领域,且长期保持主流地位,行业市场规模保持增长。数据显示,2020年我国免疫诊断试剂市场规模为321亿元,较上年同比增长24.4%;2021年我国免疫诊断试剂市场规模为387亿元,较上年同比增长20.6%。预计2022年我国免疫诊断试剂市场规模将达到445亿元。
体外诊断试剂分类
| 类别 | 诊断技术 | 应用领域 |
| 生化诊断 | 干化学 | 血/尿常规、肝/肾功能 |
| 免疫诊断 | 同位素、胶体金、乳胶比浊、化学发光、酶联免疫、放射免疫、时间分辨荧光、磁微粒化学发光 | 肿瘤及传染性疾病 |
| 分子诊断 | PCR(聚合酶链式反应)、FISH(荧光原位杂交)、基因芯片、基因测序 | 传染性疾病、遗传疾病、药物筛选 |
| 血液诊断 | 涂片+镜检、血细胞分析、流式细胞术 | 细胞定量检测 |
| 微生物诊断 | 药敏试验、培养与形态观察、全自动微生物分析 | 细菌、真菌检测 |
| POCT | 设备不同而不同 | 心脏标志物检测、血栓预防于治疗 |
资料来源:观研天下整理
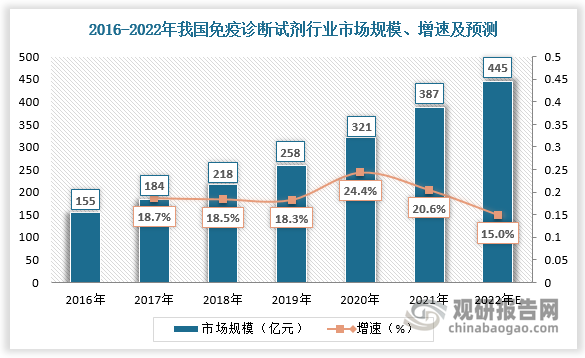
数据来源:观研天下数据中心整理
POCT(即时检测)也叫做现场快速检验,定义为在采样现场进行的、利用便携式分析仪器及配套试剂快速得到检测结果的一种检测方式。新冠疫情爆发以来,POCT(即时检测)凭借即时检测的特性成为体外诊断行业增长最快的领域之一。2020年我国POCT试剂市场规模为140亿元,较上年同比增长25%;2021年我国POCT试剂市场规模为173亿元,较上年同比增长23.6%。预计2022年我国POCT试剂市场规模将达到207亿元。
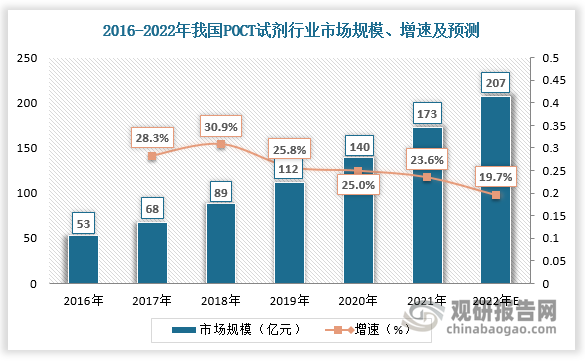
数据来源:观研天下数据中心整理
从发展潜力来看,分子诊断作为精准医疗的技术基础,得益于精准医疗的发展和分子诊断技术的不断升级,并且产前诊断、肿瘤基因检测需求的不断提升,分子诊断市场潜力不断提升,未来几年将会出现快速增长的态势。
3.本土企业多数规模较小且生产技术滞后,提升空间较大
从竞争情况来看,罗氏、雅培、丹纳赫、西门子、赛默飞等外资企业凭借高品质的IVD产品和机器同试剂绑定的方式占据我国体外诊断试剂主要市场,占据约40%的市场份额。而我国本土企业多数处于竞争弱势地位,这主要是由于体外诊断试剂企业虽然数量众多,但多数规模较小且生产技术滞后,使得我国本土体外诊断试剂企业与国外同类企业相比存在较大差距。
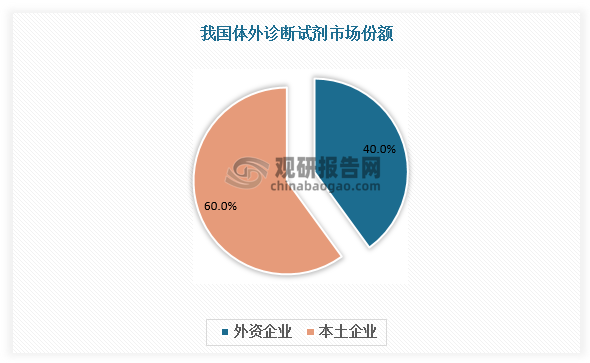
数据来源:观研天下数据中心整理
数据显示,全国体外诊断试剂原材料相关企业总数有300余家,营收过亿元的企业却仅有10家。另外,国外主要企业的产品数量最多超过30万种,而我国企业产品数量最多只有1300余种。
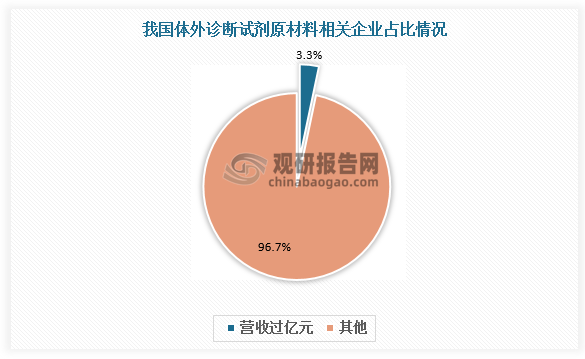
数据来源:观研天下数据中心整理
4.体外诊断试剂国产化率有待提升
此外,体外诊断试剂原料生产受限也是制约我国本土体外诊断试剂企业发展的原因之一。据数据,2021年我国体外诊断试剂原料市场中国产仅占比12.30%,进口占比高达87.7%。虽然相较前几年国产原料占比有所提升,但原料对外依存度仍然较高,阻碍国内企业从根本上改善试剂质量。本土企业应加强体外诊断试剂原材料领域的科技创新投入,不断提升产品性能,达到先进水平,从而逐渐实现国产替代。
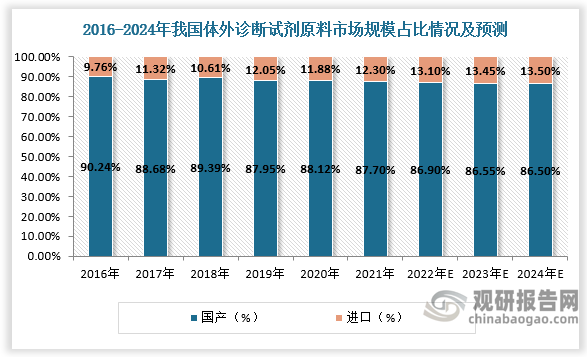
数据来源:观研天下数据中心整理(zlj)

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。







