细胞治疗利用患者自体(或异体)的成体细胞(或干细胞)对组织、器官进行修复的治疗方法。细胞治疗产品是指将人自体或异体细胞经过体外处理,回输人体后治疗或预防疾病的产品,其中体外操作包括细胞在体外的传代、扩增、筛选以及给予药物或其他能改变细胞生物学行为的处理,细胞治疗产品中经过处理的细胞发挥了主要治疗或预防疾病作用。正因如此,细胞治疗可以被广泛用于骨髓移植、晚期肝硬化、股骨头坏死、恶性肿瘤、心肌梗死等疾病。
根据观研报告网发布的《中国细胞治疗行业发展现状研究与未来投资调研报告(2022-2029年)》显示,目前,学界对细胞治疗范围尚无明确统一界定,但一般认为,细胞治疗行业的细分市场主要包括免疫细胞治疗、干细胞治疗和其他细胞治疗三大领域。其中免疫细胞治疗是通过采集人体自身免疫细胞,经过体外修饰和培养,大量扩增出靶向性杀伤功能增强的免疫效应细胞,然后再回输到患者体内,从而杀灭血液及组织中肿瘤细胞的疗法;干细胞是一类具有自我复制的多潜能细胞,在一定条件下可以分成多种功能细胞;而软骨细胞、表皮细胞等既不属于干细胞也不属于免疫细胞,因此这类被划分到其他细胞治疗。

资料来源:观研天下整理
1、政策环境
细胞治疗是以细胞为基础的再生医学疗法,代表着未来医学发展的趋势。因此在过去十年中,我国在细胞治疗领域制定了一系列重要的政策和法规。具体来看,当前我国细胞治疗行业是呈现“规范+鼓励”的双向促进的政策导向。
规范化政策方面,我国国家主要是发布一些监管类政策,促进行业的规范发展。上世纪90年代,我国在细胞治疗方面就开始的基础研究和临床试验,但是在当时行业的相关监管政策与法规相对滞后,因此在1993年到2015年间,我国对于细胞治疗政策监管方面处于自由发展阶段;在2016年经历魏则西事件之后,国家开始加强对于细胞治疗的安全性研究与临床规范管理,行业监管政策开始调整;2016年发展至今,我国细胞治疗行业经过了规范化发展现已基本形成全面监管。

资料来源:公开资料整理
鼓励政策方面,近年来,我国在包括干细胞和免疫细胞在内的细胞治疗方面政策频出,如2020年的《免疫细胞治疗产品临床试验技术指导原则(试行)》、2021年的《基因修饰细胞治疗产品非临床研究与评价技术指导原则(试行) (征求意见稿)》等都反映出国家层面对细胞治疗技术发展的推动以及临床转化的关注。
我国细胞治疗行业指导性及支持性相关政策情况
|
时间 |
政策名称 |
相关内容 |
|
2016年 |
“十三五”生物产业发展规划 |
加速新药创制和产业化,建设个体化免疫细胞治疗技术应用示范中心:建设集细胞治疗新技术开发、细胞治疗生产工艺研发,病毒载体生产工艺研发。病毒载体GMP生产、细胞治疗CGMP生产、细胞库构建等转化应用街接平台于- -体的免疫细的治疗技术开发与制备平台。 |
|
2017年 |
战路性新兴产业重点产品和服务指导录(2016年版) |
生物技术药物中提到了“针对恶性肿瘤等难治性疾病的细胞治疗产品和基因药物”。 |
|
2019年 |
知识产权重点支持产业目录(2018年本) |
将干相胞与再生医学、免疫治疗、细胞治疗、基因治疗划为国家重点发展和亟胃知识产权支持的重点产业之一。 |
|
2020年 |
免疫细胞治疗产品临床试输技术指导原则(征求意见稿)》 |
为免疫细胞治疗产品临床试验的总体规划,试验方案设计。试验实施和数据分析等方面提供技术指导,并规范了对于免疫细胞治疗产晶安全性和有效性的评价方法。 |
|
2020年 |
人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿) |
提出对于人源性干细胞治疗临床试验设计。临床试验后研究以及药品注册审评评价要点的指导。 |
|
2021年 |
免疫细胞治疗产品临床试验技术指导原则(试行) |
对细胞免疫治疗产品探索性临床试验和确证性腐床试验的若干技术问题提出了建议和推荐,并规范了对免疫细胞治疗产品的安全性和有效性的评价方法。 |
|
2021年 |
基因修饰细胞治疗产品非临床研究与评价技术指导原则(试行) (征求意见稿) |
用于基因惨饰细胞治疗产品。为规范和指导基因修饰细胞治疗产品非临床研究和评价。在《细胞制品研究与评价技术指导原则》基础上,根据目前对基因修饰细胞治疗产品的科学认识制定了本指导原则,提出了对基因修饰细胞治疗产品非临床研究和评价的特殊考虑和要求。 |
资料来源:公开资料整理
总的来说,随着我国细胞治疗行业相关政策法规的不断推出,行业已经逐步构建全面的监管体系,且相关政府部门不断规范技术指导原则并加强对细胞治疗行业发展的支持,这使得我国细胞治疗行业发展迅速,临床试验数量大幅增加。
2、行业现状
在国家政策支持下,国内细胞治疗产品迎来临床试验与上市申请快车道。就我国细胞治疗行业现状来看,目前我国免疫细胞产品已有两款产品获批上市,干细胞产品也已经有多项临床试验在进行。
(一)免疫细胞产品:已有两款产品获批上市
截至2021年12月,我国复星凯特阿基仑赛注射液(奕凯达)和药明巨诺瑞基奥仑赛注射液(倍诺达))成功获得NMPA上市批准,并正式作为药品在临床应用,这使得我国迎来两款商业化CAR-T产品,2021年也成为我国细胞疗法的元年。
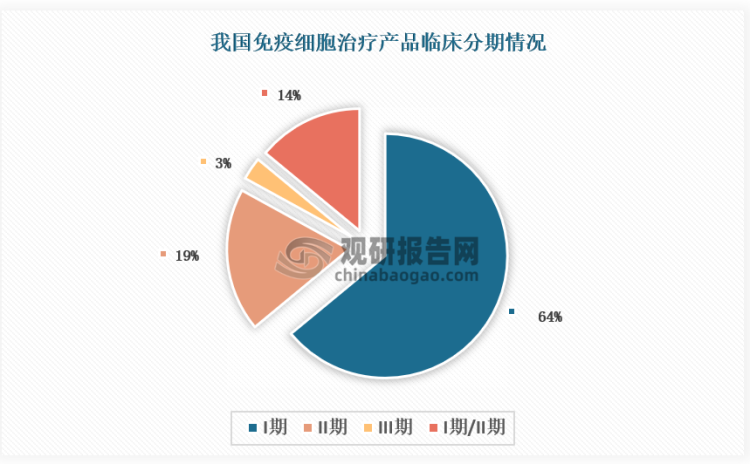
虽然当前已有两款免疫细胞产品上市,但由于细胞治疗行业技术门槛高、研发难度大等因素,所以我国在免疫细胞领域整体仍处于研发早期阶段。具体来看,截至目前,我国免疫细胞治疗领域累计有36项临床试验取得登记备案(按登记号计)。从临床分期来看,我国免疫细胞治疗领域累计有36项临床试验取得登记备案(按登记号计)。其中:处于临床I期的有23个,占64%;II期的有7个,占19%;III期的有1个,占3%;I期/II期的有5个,占14%。
资料来源:公开资料整理
(二)干细胞产品:处临床试验阶段,且临床应用及产品转化进程加快
干细胞产品治疗来看,骨髓移植(BMT)和外周血干细胞移植(PBSCT)是常见的干细胞疗法,用以恢复被高剂量化学疗法和/或放射疗法破坏的干细胞。目前海外已批准10余种干细胞产品,相比之下,我国干细胞治疗产品还是处在临床试验阶段。
近年来,我国政府也积极推进将加速干细胞临床应用及产品转化进程,2021年我国干细胞药物临床试验登记数量有8款,较2020年增加3款,现累计已有11款干细胞产品获得临床批件。
我国已登记备案的干细胞临床试验信息
|
首次日期公示信息 |
登记号 |
申办者名称 |
药物名称 |
试验分期 |
注册类 |
申请类型 |
|
2014/3/25 |
CTR20132698 |
中国医学科学院基础医学研究所 |
骨髓原始间充质干细胞 |
Ⅱ期 |
未公示 |
补充申请 |
|
2014/4/3 |
CTR20132003 |
中国医学科学院基础医学研究所 |
骨髓原始问充质干细胞 |
Ⅱ期 |
未公示 |
补充申请 |
|
2014/5/8 |
CTR20132028 |
北京源和发生物技术有 限公司、泰达国际心血管病医院 |
间充质干细胞心梗注射液 |
Ⅰ期 |
3 |
新药 |
|
2020/6/12 |
CTR20200887 |
铂生卓越生物科技 (北京) |
人脐带间充质干细胞注射液 |
Ⅱ期 |
- |
新药- |
|
2020/7/20 |
CTR20201158 |
北京汉氏联合 |
人胎盘问充质干细胞凝胶 |
Ⅰ期 |
1 |
新药 |
|
2020/10/20 |
CTR20201577 |
天津昂赛细胞 |
注射用问充质干细胞脐带 |
Ⅰ期 |
1 |
新药 |
|
2021/1/28 |
CTR20210039 |
上海爱萨尔生物科技有 限公司 |
人脐带间充质干细胞注射液 |
Ⅱ期 |
1 |
新药 |
|
2021/3/1 |
CTR20210349 |
江西省仙荷医学科技有限公司 |
REGEND001细胞自体回输制剂 |
探索性临床 |
1 |
新药 |
|
2021/4/2 |
CTR20210590 |
北京贝来生物 |
eC-UO01低剂量组 |
Ⅰ+Ⅱa 期 |
1 |
新药 |
|
2021/6/8 |
CTR20211297 |
广州辑因医疗科技有限公司 |
CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液 |
Ⅰ期 |
1 |
新药 |
|
2021/6/17 |
CTR20211389 |
北京三有利和泽生物首都医科大学 |
人牙髓问充质干细胞注射液 |
Ⅰ期 |
3 |
新药 |
|
2021/8/31 |
CTR20212107 |
青岛奥克生物 |
人脐带问充质干细胞注射液 |
Ⅰ期 |
3 |
新药 |
|
2021/9/13 |
CTR20212223 |
天津昂赛细胞 |
注射用间充质干细胞(脐带) |
Ⅰ+Ⅱ |
1 |
新药 |
除此之外,据公开信息披露,过去的2021年,我国共完成干细胞临床研究机构备案的三甲医院已经达到133家,占全国三甲医院的十分之一以上;共计有111个临床试验项目完成了干细胞临床研究项目备案;国家药品审批中心一共受理了10家公司的干细胞新药IND申报工作。
3、发展前景
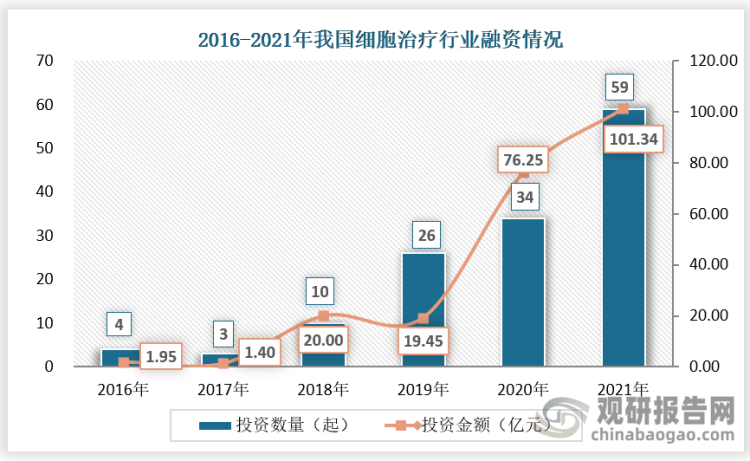
生物医药技术领城一直以来都是我国医疗产业的投资热点,近年来国内细胞治疗领域热度升温,投融资市场活跃。2021年两款CAR-T产品的顺利获批对于行业的发展起到了重要的刺激作用,在2021年我国细胞治疗领域的融资热度进一步走高,融资总额突破百亿元大关。根据数据显示,2021年,我国细胞治疗领域投融资事件达59起,较2020年增加25起,投融资金额达101.34亿元,较2020年增加25.09亿元。
资料来源:公开资料整理
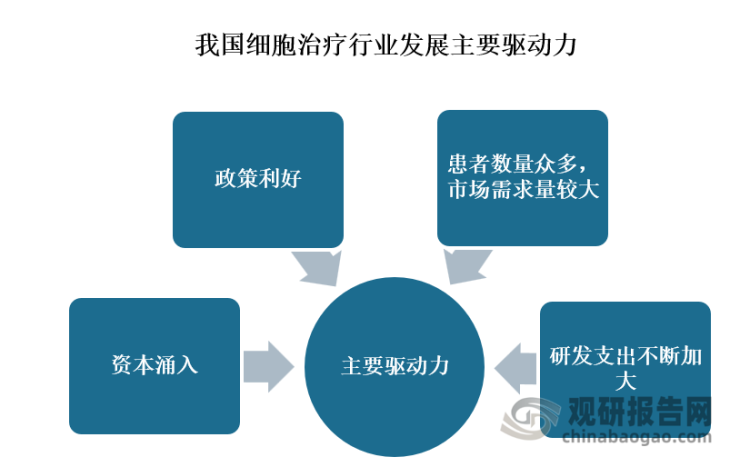
细胞治疗领城的资本投入不断增加,可见我国细胞治疗市场发展潜力较大,而且可以预见且资本注入将推动细胞治疗行业的发展。除了资本持续涌入加持之外,行业政策利好、市场需求量大、研发投入的支持等因素都将促进我国细胞治疗行业的发展。
资料来源:观研天下整理
当前我国政策上政府及相关部门积极推动细胞治疗产品转化。市场需求方面,根据世界卫生组织国际癌症研究机构数据显示,在2020年我国有457万癌症新发病例和300万死亡例,癌症新发病例和死亡病例均位居全球第一,并呈增长趋势。在我国癌症新发病例中约有10%为血液瘤,即约有46万的血液瘤患者,假设有10%适用于免疫细胞治疗并可以支付(个人、医保等多方支付),则我国约有4.6万人/年的市场需求。另外,随着制药公司不断增加研发支出,开展新兴生物技术研发,未来细胞治疗市场将进一步增长。总的来说,我国细胞治疗行业成长性高、发展潜力大,且行业发展驱动力足,发展前景广阔。(LQM)

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。