我国生物医药获政策支持力度不断加大,鼓励行业发展与创新
生物医药产业是国民经济的重要组成部分,生物医药产业的发展是一个庞大而复杂的生态系统,包括天然药物种植、原料药加工、药品研发、生产、商业流通、医疗服务等多个行业。它是以产业链为基础形成的跨行业、跨领域的生态系统。
根据观研报告网发布的《中国生物医药行业发展深度调研与投资战略预测报告(2022-2029年)》显示,生物医药是我国医药体系的重要分支。“八五”计划(1991-1995年)至“十五”计划(2001-2005年)时期,国家层面经历了“发展、重点攻克、战略布局”生物医药行业的过程。近年来,国务院、发改委、药监局、市场监督局等多部门都陆续印发了支持、规范生物医药行业的发展政策,内容涉及生物医药发展趋势、生物医药研发生产规范、生物医药新技术等内容。另外,生物医药细分领域如疫苗、诊断试剂等,国家也出台了相应的扶持发展政策。
近年来我国生物医药产业政策
| 时间 | 部门 | 政策名称 | 重点内容 | 政策类型 |
| 2022/5/10 | 国家发展和改革委员会 | 《“十四五"生物经济发展规划》 | 《规划》明确了生物经济4大重点发展领域。一是顺应"以治病为中心"转向"以健康为中心""的新趋势,发展面向人民生命健康的生物医药。二是J顺应"解决温饱"转向"营养多元""的新趋势,发展面向农业现代化的生物农业。三是顺应"追求产能产效"转向"坚持生态优先"的新趋势,发展面向绿色低碳的生物质替代应用。四是顺应"被动防御"转向"主动保障""的新趋势,加强国家生物安全风险防控和治理体系建设。 | 支持类 |
| 2022/3/10 | 国家市场监督管理总局、工业和信息化部 | 《关于推进国家级质量标准实验室建设的指导意见》 | 到2025年,力争在高端制造、新材料、信息技术、生物医药等重点领域建设若干国家级质量标准实验室。到2035年,基本建成同现代产业体系发展与安全保障相适应的国家级质量标准实验室体系。 | 支持类 |
| 2021/12/31 | 国务院 | 《关于印发计量发展规划(2021—2035年)的通知》 | 加快医疗健康领域计量服务体系建设,围绕疾病防控、生物医药、诊断试剂、高端医疗器械、康复理疗设备、可穿戴设备、营养与保健食品等开展关键计量测试技术研究和应用。 | 支持类 |
| 2021/12/30 | 国家药品监督管理局 | 《“十四五"国家药品安全及促进高质量发展规划》 | 现代生物医药新技术、新方法、新商业模式日新月异,对传统监管模式和监管能力形成挑战。药品监管信息化水平需进一步提高,技术支撑体系建设有待加强。药品监管队伍力量与监管任务不匹配、监管人员专业能力不强的问题仍然较突出。新型冠状病毒肺炎疫情的暴发反映出人类面临的新型疾病风险越来越大,对药品研发、安全和疗效提出了新的需求。 | 支持类 |
| 2021/3/12 | 国家卫生健康委员会 | 《国家免疫规划疫苗儿童免疫程序及说明(2021年版)》 | 新版程序及说明主要有两大变化,一是优化调整部分接种程序和剂型,二是对长期困扰基层医疗工作者、临床医生和家长的常见特殊健康状态儿童接种问题进行了说明。 | 规范类 |
| 2020/12/11 | 国家市场监督管理总局 | 《生物制品批签发管理办法(2020修订版)》 | 从申请、检验、审核与签发、复审、监督与处罚等方面对生物制品批签发制度做了规定。 | 规范类 |
| 2020/3/30 | 国家市场监督管理总局 | 《药品生产监督管理办法(2020修订版)》 | 该办法规定了对药品生产条件和生产过程进行审查、许可、监督检查等管理活动。修订版在坚持属地监管原则的基础上,细化了药监部门在药品生产环节的监管事权;明确MAH全生命周期管理责任;部分药品自行和委托生产均需获得药品生产许可证;全流程质量控制;实行药品年度报告和短缺药品报告等。 | 规范类 |
| 2020/3/16 | 中国疾病预防控制中心 | 《关于印发因新型冠状病毒肺炎疫情防控疫苗迟种补种技术方案的通知》 | 受疫情影响,很多疫苗接种被耽搁了约2个月,中国疾病预防控制中心下发通知,建议优先补种免疫规划疫苗,传染性强,危害性大的疾病的疫苗。 | 支持类 |
| 2020/3/15 | 国家卫生健康委员会 | 《关于统筹做好新冠肺炎疫情防控全面有序开展预防接种工作的通知》 | 国家卫生健康委下发该通知,因当前新冠肺炎疫情防控态势总体积极向好,复工复产正有序展开,预防接种工作也在毫不放松新冠肺炎疫情防控工作的前提下,各地应逐步正常推进疫苗接种工作。 | 支持类 |
| 2019/12/24 | 国家药品监督管理局 | 《预防用疫苗临床可比性研究技术指导原则》 | 进一步规范和提高疫苗临床研发水平,落实国家关于加强疫苗质量安全监督工作的要求,明确和统一临床技术标准,保证同类疫苗注册上市时具有相似的安全性和有效性,指导非创新疫苗的临床研究和评价。 | 规范类 |
| 2019/8/26 | 国务院 | 《中华人民共和国药 品管理法》 | 《药品管理法》明确取消 GMP/GSP认证、要 求全面实施上市许可持有人制度、建立药物警 戒制度、制定药品上市后风险管理计划等。 | 规范类 |
| 2019/6/29 | 国务院 | 《中华人民共和国疫苗管理法》 | 强调疫苗上市许可持有人应加强疫苗生命周期质量管理,对疫苗安全性、有效性和质量可控性负责;鼓励疫苗上市许可持有人加大研制和创新资金投入、优化生产工艺.提升质控水平、推动疫苗技术进步;鼓励疫苗生产规模化、集约化、支持疫苗基础研究和应用研究,促进疫苗研制和创新,将预防、控制重大疾病的疫苗研制、生产和储备纳入国家战略。 | 规范类 |
| 2018/9/20 | 国家卫生健康委员会 | 《新型抗肿瘤药物临床应用指导原则(2018年版)》 | 根据药物适应证、药物可及性和肿瘤治疗价值,将抗肿瘤药物分为普通使用级和限制使用级。 | 规范类 |
数据来源:观研天下数据中心整理
中国生物医药行业凭借持续政策改革带来的机遇,逆境中迸发出创新活力,2021年国家层面陆续印发了支持、规范生物医药行业的发展政策,内容涉及生物医药发展技术路线、生物医药研发生产规范、资金扶持等内容,出台重大项目产业化扶持政策,加快生物医药行业相关企业在当地形成集聚化效应;2021年,从政策发布部门来看,CDE发布政策数量最多,他们坚持国际视野,立足我国国情,本年度制定发布了多个生物医药相关技术指导原则,有效弥补了国内技术指导原则体系缺口,调动了生物药研发与创新的积极性,也达到了统一审评标准、提升审评能力、提高审评决策科学性的目的。
近年来生物医药行业有关技术指导原则
| 分类 | 政策名称 | 状态 | 发布日期 |
| 非临床 | 药物免疫原性研究技术指导原则 | 颁布 | 2021/3/29 |
| 非临床 | S1B(R1):药物致癌性试验:S1B增补文件 | 征求意见稿 | 2021/6/9 |
| 非临床 | 新型冠状病毒中和抗体类药物非临床研究技术指导原则(试行) | 征求意见稿 | 2021/8/17 |
| 非临床 | 纳米药物非临床安全性研究技术指导原则(试行) | 颁布 | 2021/8/27 |
| 非临床 | 纳米药物非临床药代动力学研究技术指导原则(试行) | 颁布 | 2021/8/27 |
| 非临床 | 药物非临床依赖性研究技术指导原则 | 征求意见稿 | 2021/8/30 |
| 非临床 | 基因修饰细胞治疗产品非临床研究技术指导原则(试行) | 颁布 | 2021/12/3 |
| 非临床 | 基因治疗产品非临床研究与评价技术指导原则(试行) | 颁布 | 2021/12/3 |
| 非临床 | 抗新冠病毒肺炎炎症药物非临床药效学研究与评价技术指导原则 | 颁布 | 2021/12/7 |
| 非临床 | 新型冠状病毒中和抗体类药物非临床研究技术指导原则 | 颁布 | 2021/12/7 |
| 临床 | 抗肿瘤药临床试验影像评估程序标准技术指导原则 | 颁布 | 2021/1/15 |
| 临床 | 治疗绝经后骨质疏松症创新药临床试验技术指导原则 | 颁布 | 2021/1/18 |
| 临床 | 药物相互作用研究技术指导原则(试行) | 颁布 | 2021/1/26 |
| 临床 | 注射用奥马珠单抗生物类似药临床试验指导原则(试行) | 颁布 | 2021/2/4 |
| 临床 | 治疗性蛋白药物临床药代动力学研究技术指导原则 | 颁布 | 2021/2/7 |
| 临床 | 溶瘤病毒类药物临床试验设计指导原则(试行) | 颁布 | 2021/2/9 |
| 临床 | 静注人免疫球蛋白治疗原发免疫性血小板减少症临床试验技术指导原则(试行) | 颁布 | 2021/2/10 |
| 临床 | 免疫细胞治疗产品临床试验技术指导原则(试行) | 颁布 | 2021/2/10 |
| 临床 | 生物类似药相似性评价和适应症外推技术指导原则 | 颁布 | 2021/2/18 |
| 临床 | 帕妥珠单抗注射液生物类似药临床试验指导原则 | 颁布 | 2021/4/22 |
| 临床 | 托珠单抗注射液生物类似药临床试验指导原则 | 颁布 | 2021/4/22 |
| 临床 | 每日一次基础胰岛素生物类似药临床研究设计指导原则 | 征求意见稿 | 2021/5/12 |
| 临床 | 克罗恩病治疗药物临床试验技术指导原则 | 征求意见稿 | 2021/7/2 |
| 临床 | 溃疡性结肠炎治疗药物临床试验技术指导原则 | 征求意见稿 | 2021/7/15 |
| 临床 | 人纤维蛋白原临床试验技术指导原则 | 征求意见稿 | 2021/7/22 |
| 临床 | 急性非静脉曲张性上消化道出血治疗药物临床试验技术指导原则 | 颁布 | 2021/8/5 |
| 临床 | 抗狂犬病病毒单克隆抗体新药临床试验技术指导原则 | 征求意见稿 | 2021/8/17 |
| 临床 | 预防抗肿瘤药物所致恶心呕吐药物临床试验设计指导原则 | 征求意见稿 | 2021/8/18 |
| 临床 | 创新药人体生物利用度和生物等效性研究技术指导原则 | 征求意见稿 | 2021/8/25 |
| 临床 | 化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行) | 颁布 | 2021/9/3 |
| 临床 | 患者报告结局在药物临床研究中应用的指导原则 | 征求意见稿 | 2021/9/3 |
| 临床 | 新型冠状病毒肺炎抗病毒治疗及预防新药临床试验技术指导原则(试行) | 征求意见稿 | 2021/9/3 |
| 临床 | 西妥昔单抗注射液生物类似药临床试验设计指导原则 | 征求意见稿 | 2021/9/8 |
| 临床 | 药物临床试验随机分配指导原则 | 征求意见稿 | 2021/9/8 |
| 临床 | 药物临床试验中心化监查统计指导原则 | 征求意见稿 | 2021/9/16 |
| 临床 | 待立帕肽注射液生物类似药临床试验设计指导原则 | 征求意见稿 | 2021/9/30 |
| 临床 | 罕见疾病药物临床研发技术指导原则 | 征求意见稿 | 2021/10/11 |
| 临床 | 长效粒细胞集落刺激因子预防化疗后感染临床试验设计技术指导原则 | 征求意见稿 | 2021/10/11 |
| 临床 | 人用狂犬病疫苗临床研究技术指导原则 | 征求意见稿 | 2021/10/13 |
| 临床 | 慢性髓细胞白血病药物临床试验中检测微小残留病的技术指导原则 | 颁布 | 2021/11/11 |
| 临床 | 多发性骨髓瘤药物临床试验中应用微小残留病的技术指导原则 | 颁布 | 2021/11/19 |
| 临床 | 以临床价值为导向的抗肿瘤药物临床研发指导原则 | 颁布 | 2021/11/19 |
| 临床 | 季节性流感病毒疫苗临床研究技术指导原则 | 征求意见稿 | 2021/11/19 |
| 临床 | 基因治疗产品长期随访临床研究技术指导原则(试行) | 颁布 | 2021/12/3 |
| 临床 | 生物标志物在抗肿瘤药物临床研发中应用的技术指导原则 | 颁布 | 2021/12/7 |
| 临床 | 静脉麻醉药的临床评价技术指导原则 | 征求意见稿 | 2021/12/7 |
| 临床 | 体重控制药物临床试验技术指导原则 | 颁布 | 2021/12/8 |
| 临床 | 晚期前列腺癌临床试验终点技术指导原则 | 征求意见稿 | 2021/12/8 |
| 临床 | 晚期结直肠癌新药临床试验设计指导原则 | 颁布 | 2021/12/29 |
| 临床药理 | 肾功能不全患者的药代动力学研究技术指导原则 | 征求意见稿 | 2021/7/8 |
| 临床药理 | 生物类似药临床药理学研究技术指导原则 | 征求意见稿 | 2021/7/8 |
| 临床药理 | 新药研发过程中食物影响研究技术指导原则 | 征求意见稿 | 2021/8/24 |
| 临床药理 | 创新药临床药理学研究技术指导原则 | 颁布 | 2021/12/20 |
| 临床药理 | 抗肿瘤药首次人体试验扩展队列研究技术指导原则(试行) | 颁布 | 2021/12/29 |
| 临床药理 | 药物临床研究有效性综合分析指导原则(试行) | 颁布 | 2021/12/30 |
| 生物统计 | 药物临床试验适应性设计指导原则(试行) | 颁布 | 2021/1/29 |
| 生物统计 | 用于产生真实世界证据的真实世界数据指导原则(试行) | 颁布 | 2021/4/15 |
| 生物统计 | 药物临床试验数据管理与统计分析计划指导原则 | 征求意见稿 | 2021/9/3 |
| 生物统计 | 罕见疾病药物临床研究统计学指导原则 | 征求意见稿 | 2021/11/18 |
| 药学 | 门冬氨酸鸟氨酸注射液药学研究技术要求 | 征求意见稿 | 2021/1/27 |
| 药学 | 溶瘤病毒产品药学研究与评价技术指导原则 | 征求意见稿 | 2021/4/30 |
| 药学 | 已上市生物制品药学变更研究技术指导原则(试行) | 颁布 | 2021/6/25 |
| 药学 | 人源性干细胞产品药学研究与评价技术指导原则 | 征求意见稿 | 2021/8/17 |
| 药学 | 胰岛素类产品药学研究与评价技术指导原则 | 征求意见稿 | 2021/8/17 |
| 药学 | 纳米药物质量控制研究技术指导原则(试行) | 颁布 | 2021/8/27 |
| 药学 | 人特异性免疫球蛋白药学研究与评价技术指导原则 | 征求意见稿 | 2021/10/15 |
| 变更 | 已上市化学药品和生物制品临床变更技术指导原则 | 颁布 | 2021/2/10 |
| 变更 | 境外生产药品上市后备案类变更办理程序和要求 | 征求意见稿 | 2021/8/30 |
| 多学科 | 药品电子通用技术文档(eCTD)技术规范V1.0 | 颁布 | 2021/10/14 |
| 多学科 | 药品电子通用技术文档(eCTD)实施指南V1.0 | 颁布 | 2021/10/14 |
| 多学科 | 药品电子通用技术文档(eCTD)验证标准V1.0 | 颁布 | 2021/10/14 |
| 药物警戒 | 安全性参考信息示例 | 征求意见稿 | 2021/7/8 |
| 药物警戒 | 研究者手册中安全性参考信息撰写技术指导原则 | 征求意见稿 | 2021/7/8 |
| 药物警戒 | 风险分析与管理计划撰写指导原则 | 征求意见稿 | 2021/7/23 |
| 药物警戒 | 抗肿瘤药物说明书不良反应数据汇总指导原则 | 征求意见稿 | 2021/8/18 |
| 药物警戒 | 嵌合抗原受体T细胞(CAR-T)产品申报上市临床风险管理计划技术指导原则 | 征求意见稿 | 2021/9/18 |
| 药物警戒 | 抗肿瘤治疗的免疫相关不良事件评价指导原则 | 征求意见稿 | 2021/11/26 |
数据来源:观研天下数据中心整理
国内生命科学领域研究资金投入不断增大,带动生物医药产业发展
随着全球医药领域的快速发展,以及全世界民众对健康的重视,作为医药产业的核心基础,生命科学领域研究一直都处在快速发展期。相应的,全球生命科学领域研究资金投入快速增长,2020年资金投入达到1576亿美元,2021年资金投入接近1600亿美元。
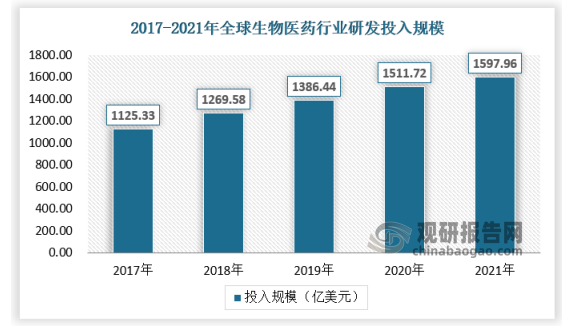
数据来源:观研天下数据中心整理
与此同时,在国家科技强国战略的指导下,随着我国对生命科学领域的重视,以及国内医药行业创新浪潮的兴起,无论是科研机构基础科研投入还是生物医药企业的研发投入持续增长,均带动我国生命科学领域研究资金投入持续快速增长。2021年研究投入高达928亿元,年复合增长率接近全球年复合增速的三倍。
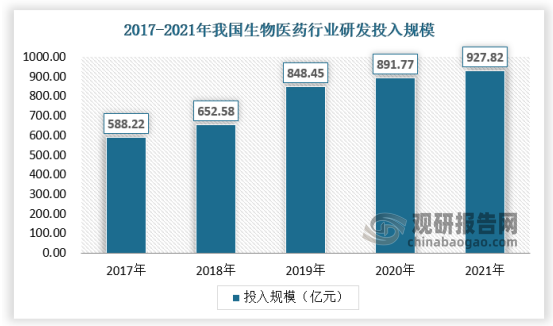
数据来源:观研天下数据中心整理
国内医药十四五规划中的“医药工业向创新驱动转型、实现高质量发展的关键五年”的方针以及国家推动医药科研转化,要求提升研究机构、医院和企业之间的研发合作叠加在新冠疫情发生后,政府对于生命科学和疾病领域的研究支持不断增强,未来国内科研基础经费的投资仍将保持较快增长。因此长期来看,我国生命科学领域研究还将保持较快增长,从而带动生物医药市场不断扩大。(zppeng)

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。