一、概述
化学原料药指用于生产各类制剂的原料药物,是制剂中的有效成份,由化学合成、植物提取或者生物技术所制备的各种用来作为药用的粉末、结晶、浸膏等,但病人无法直接服用的物质。总体来看,医药行业内一直将原料药生产企业划分为大宗原料药和特色原料药两个子行业。
化学原料药分类(按产品价值和产品特性)
|
分类 |
特征 |
|
大宗原料药 |
工艺成熟、需求量大的非专利名药,如传统的抗生素、维生素、镇痛息热等三大类,属于临床上疗效确切、毒副作用低、适用症广泛的通用名药产品;市场稳步增长,与国民的基础医疗保障密切相关。 |
|
特色原料药 |
专利即将过期的,并且在世界范围内有重磅级销售水平的药品原料药;生产企业已掌握了可避开专利的成熟生产工艺技术;在国际规范市场所在国家进行药品认证;认证后的原料药将被制剂厂家用来作为其提出制剂生产和在欧美上市申请的原料药来源。 |
数据来源:观研天下整理
二、发展现状
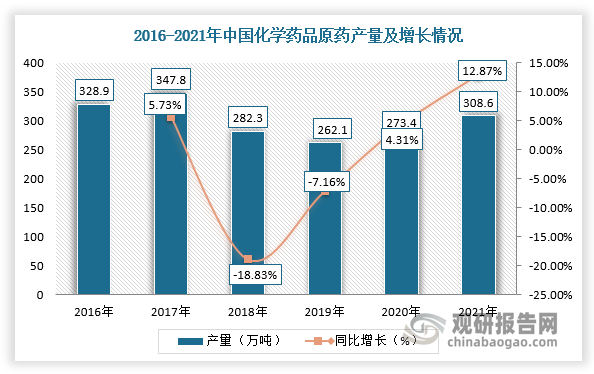
根据观研报告网发布的《中国化学原料药行业现状深度分析与发展前景研究报告(2022-2029年)》显示,化学原料药行业是我国医药工业战略支柱之一,经过几十年发展已形成比较完备的工业体系,并且具有规模大、成本低、产量高的特点。2018-2019年,由于国家实施征收环境保护税政策,原料药低端产能加速出清,化药产量出现大幅下降,2020-2021年化药产量开始保持稳定回升。根据数据显示,2021年,中国化学药品原药产量为308.6万吨,同比增长12.87%。
数据来源:观研天下整理
同时,受益于大宗原材料价格和跨境物流费用的单边上涨,我国化学药品原料药出口均价上涨,出口金额整体呈增长趋势。根据数据显示,2021年,化学药品原料药出口金额为417.7亿元,同比增长17%。

数据来源:观研天下整理
三、发展机遇
1、国家强有力的产业政策支持
医药工业是中国制造2025和战略性新兴产业的重点领域,是推进健康中国建设的重要保障,所以近年来我国出台了一系列政策来支持医药产业发展,这也为化学原料药行业发展创造良好的产业环境。
我国化学原料药行业相关政策
| 政策名称 | 颁布部门及日期 | 政策摘要 |
| 医药工业发展规划指南 | 工信部、发改委、商务部等2016.1 | 支持仿制药大品种技术改造和质量升级;选择环境承载和环保治理能力强的适宜地区,建设3-5个化学原料药循环经济园区,推动原料药生产集群发展;巩固化学原料药国际竞争地位,提高精深加工产品出口比重,增加符合先进水平GMP要求的品种数量。立足原料药产业优势,实施制剂国际化战略,全面提高我国制剂出口规模、比重和产品附加值,重点拓展发达国家市场和新兴医药市场。 |
| 关于开展仿制药质量和疗效一致性评价的意见 | 国务院办公厅2016.2 | 一致性评价的实施对提升我国制药行业整体水平,保障药品安全性和有效性,促进医药产业升级和结构调整,提升药品国际竞争力等方面具有十分重要的意义。意见中明确了一致性评价的时限和对象,规定了化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致性原则审批的,均要求开展一致性评价。意见也明确了一致性评价工作中企业的主体责任:药品生产企业是一致性评价工作的主体,应主动选购参比制剂开展相关研究,确保药品和疗效与参比制剂一致 |
| 促进医药产业健康发展的指导意见 | 国务院办公厅2016.3 | 鼓励企业加强技术创新,提高核心竞争能力,完善政产学研用的医药协同创新体系;加快质量升级,促进绿色安全发展,全面实施并严格执行新版药品生产质量管理规范(GMP),优化产业结构,提升集约发展水平,并紧密衔接医改,营造良好市场环境。 |
| “十三五”国家战略性新兴产业发展规划 | 国务院2016.11 | 加快开发具有重大临床需求的创新药物和生物制品,加快推广绿色化、智能化制药生产技术,强化科学高效监管和政策支持,推动产业国际化发展,加快建设生物医药强国。 |
| “十三五”深化医药卫生体制改革规划 | 国务院2016.12 | 实施药品生产、流通、使用全流程改革,调整利益驱动机制,破除以药补医,推动各级各类医疗机构全面配备、优先使用基本药物,建设符合国情的国家药物政策体系,理顺药品价格,促进医药产业结构调整和转型升级,保障药品安全有效、价格合理、供应充分。 |
| 关于改革完善仿制药供应保障及使用政策的意见 | 国务院2018.3 | 制定鼓励仿制的药品目录。建立跨部门的药品生产和使用信息共享机制,强化药品供应保障及使用信息监测,及时掌握和发布药品供求情况,引导企业研发、注册和生产。以需求为导向,鼓励仿制临床必需、疗效确切、供应短缺的药品,鼓励仿制重大传染病防治和罕见病治疗所需药品、处置突发公共卫生事件所需药品、儿童使用药品以及专利到期前一年尚没有提出注册申请的药品。 |
| 关于调整药物临床试验审评审批程序的公告 | 国家药品监督管理局2018.7 | 标志着我国临床试验由“批准制”改为“默认制”。这意味着我国临床试验申请自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心否定或质疑意见的,即可开展临床试验,此举将大大提升国内创新药物临床开发进程。 |
| 关于仿制药质量和疗效一致性评价有关事项的公告 | 国家药品监督管理局2018.12 | 对纳入国家基本药物目录的品种,不再统一设置评价时限要求;化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。逾期未完成的,企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请,经省级药品监管部门会同卫生行政部门组织研究认定后,可予适当延期。逾期再未完成的,不予再注册。 |
| 国家组织药品集中采购和使用试点方案 | 国务院2019.1 | 进一步明确了未来集中采购试点的规则,并且对于后续的回款、药品使用以及保证医院积极性等方面做了进一步安排。药品集中采购有利于降低药品价格,破除公立医院以药养医的不合理机制,从而减轻群众用药负担。与此同时,也能有效遏制药品购销领域的腐败,推动药品生产流通企业的整合重组,从而促进医药产业健康发展。 |
| 推动原料药产业绿色发展的指导意见 | 工业和信息化部、生态环境部、国家卫生健康委员会、国家药品监督管理局2019.12 | 明确主要目标:到2025年,产业结构更加合理,采用绿色工艺生产的原料药比重进一步提高,高端特色原料药市场份额显著提升;产业布局更加优化,原料药基本实现园区化生产,打造一批原料药集中生产基地;技术水平有效提升,突破20项以上绿色关键共性技术,基本实现行业绿色生产技术替代;绿色标准不断完善,建立原料药绿色工厂、绿色园区、绿色管理标准评价体系,发挥优势企业绿色发展引领作用;清洁生产水平明显提高,单位工业增加值能耗、二氧化碳排放量、用水量以及二氧化硫、氮氧化物、挥发性有机物等主要污染物排放强度逐步下降。 |
数据来源:观研天下整理
2、重大公共卫生事件客观上推动化学原料药行业加快发展
2019-2020年,新型冠状病毒肺炎的爆发,促使国家和人民进一步认识到我国公共卫生服务体系医疗服务需求与有限供给的矛盾。未来,国家将更加重视完善医疗卫生服务体系,加快提升医疗卫生服务财政支出,这将有利于促进化学原料药行业高质量发展。
3、关联审评和一致性评价推动生产质量高标准化
在关联审评审批制度下,生产厂商假设需要更换原料药,则要重新对工艺和质量标准进行研究和审评审批,并且一致性评价政策使得原料药亦需满足原研标准。由此可见,生产制造企业更青睐与质量较高、供应稳定的化学原料药企业建立长期合作关系,进而推动行业高工艺和产品质量标准化发展。(WYD)

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。