1、创新药概述
2016年3月,国家药品监督管理局发布了《关于发布化学药品注册分类改革工作方案的公告》,将化药新药分为创新药和改良型新药,其中创新药是指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。按照药品形态,创新药可分为小分子、大分子、细胞治疗、基因治疗、活体微生物等;按照注册方式,可以分为化学药、生物药和中药;按照国际惯例,分为首创创新药和仿制创新药。
2、政策驱动,我国创新药行业迎来高景气发展
根据观研报告网发布的《中国创新药行业发展深度分析与投资前景研究报告(2024-2031年)》显示,近年来,创新药行业受到各级政府的高度重视和国家产业政策的重点支持,陆续出台多项政策,主要目标是促进国内创新药的发展,以满足不断增长的医疗需求,并加速创新药的审批和上市流程,迅速地将创新治疗推向市场,为创新药行业发展提供明确、广阔市场前景。
例如,2023年8月,国务院常务委员会审议通过《医药工业高质量发展行动计划(2023-2025年)》,首次提出“全链条”概念,会议指出,要着力提高医药工业和医疗装备产业韧性和现代化水平,增强高端药品、关键技术和原辅料等供给能力,加快补齐我国高端医疗装备短板。要着眼医药研发创新难度大、周期长、投入高的特点,给予全链条支持,鼓励和引导龙头医药企业发展壮大,提高产业集中度和市场竞争力。
2022-2023年我国创新药行业相关政策及重点内容解读
|
时间 |
部门 |
政策名称 |
重点内容 |
政策类型 |
|
2023年8月 |
国务院常务委员会 |
《医药工业高质量发展行动计划(2023-2025年)》 |
首次提出“全链条”概念,会议指出,要着力提高医药工业和医疗装备产业韧性和现代化水平,增强高端药品、关键技术和原辅料等供给能力,加快补齐我国高端医疗装备短板。要着眼医药研发创新难度大、周期长、投入高的特点,给予全链条支持,鼓励和引导龙头医药企业发展壮大,提高产业集中度和市场竞争力 |
支持类 |
|
2023年7月 |
国家卫健委 |
《深化医药卫生体制改革2023年下半年重点工作任务》 |
推进医药领域改革和创新发展。支持药品研发创新,常态化开展药品和医用耗材集中带量采购,加强药品供应保障和质量监管确保"供好药"用好药"。 |
支持类 |
|
2023年4月 |
国家药品监督管理局药品审评中心(CDE) |
《药审中心加快创新药上市许可申请审评工作规范(试行)》 |
此次审评审批提速针对的是纳入突破性治疗药物程序的创新药、儿童创新药和罕见病创新药三类创新药品,将加速这三类药品上市,满足相关患者的用药需求。 |
支持类 |
|
2023年4月 |
国务院 |
《"十四五"市场监管现代化规划》 |
稳步提升药品安全性有效性可及性。优化管理方式促进新药好药加快上市。完善创新药物、创新疫苗、医疗器械等快速审评审批机制,加快临床急需和罕见病治疗药品、医疗器械审评审批。建立国家药物医疗器械创新协作机制,加强对重大创新药研发的指导。鼓励研制短缺药品、儿童用药品,防治重大传染病药品,公共卫生方面急需药品,鼓励新药境内外同步研发申报。 |
指导类 |
|
2022年5月 |
国务院 |
《"十四五”国民健康规划》 |
深化药品医疗器械审评审批制度改革,对符合要求的创新药、临床急需的短缺药品和医疗器械、罕见病治疗药品等,加快审评审批。 |
支持类 |
|
2022年5月 |
国家药监局 |
《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》 |
药品注册申请期间专利权存在纠纷的,当事人可以向入民法院提起诉讼或者向国务院专利行政部门申请行政裁决,期间不停止药品技术审评。 |
支持类 |
|
2022年3月 |
国家药品监督管理局药品审评中心(CDE) |
《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》 |
单臂临床试验的研发策略显著地缩短了新药的上市时间;特别是近年来,许多新药在临床研究早期阶段就显现出非常突出的有效性数据,因此,越来越多的研发企业希望采用单臂临床试验支持抗肿瘤药物的上市申请。 |
指导类 |
|
2022年2月 |
国家药品监督管理局药品审评中心(CDE) |
《药审中心加快创新药上市申请审评工作程序(试行)(征求意见稿)》 |
主要内容为鼓励研究和创制新药,满足临床用药需求,及时总结转化抗疫应急审评工作经验,加快创新药品的审评速度。 |
支持类 |
|
2022年1月 |
工信部等九部门 |
《“十四五”医药工业发展规划》 |
推动创新药和高端医疗器械产业化与应用、健全医药创新支撑体系。 |
支持类 |
|
2022年1月 |
国务院 |
《“十四五”市场监管现代化规划》 |
完善创新药物、创新疫苗、医疗器械等快速审评审批机制,加快临床急需和罕见病治疗药品、医疗器械审评审批 |
指导类 |
资料来源:观研天下整理
3、我国创新药获批数量居历史高位,抗肿瘤、抗感染药是重要发展方向
根据中国医药工业信息中心数据显示,2021年,我国NMPA批准了39款新药,超之前四年总和;2022年由于疫情等原因,获批数量有所减少,但2023年创新药获批数量恢复至40款,其中进口新药6款,国产新药34款。
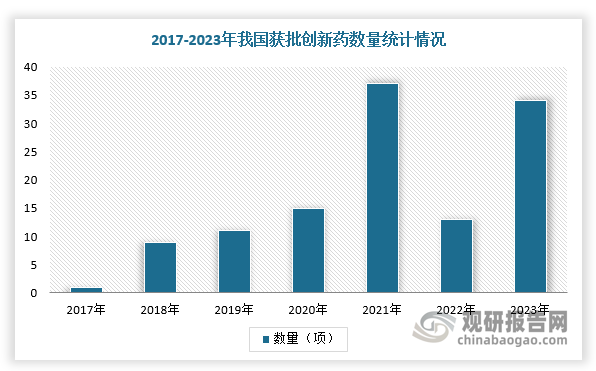
数据来源:观研天下整理
从细分品种来看,2023年,我国NMPA批准的创新药中,抗肿瘤药获批数量依旧位居榜首,达14项,占比35%;抗感染药获批数量位居第二,共9项,占比22.5%;其次是中药,共4项,占比10%。
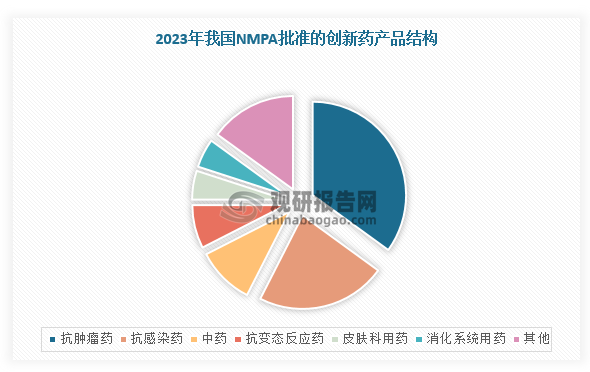
数据来源:观研天下整理
从药品类型来看,涉及19款化学药品、2款预防用生物制品、14款治疗用生物制品、5款中药,化药创新药和治疗用生物创新药占据82.5%获批份额。
2023年我国部分创新药获批情况
|
序号 |
药品名称 |
上市许可持有人 |
药品类型 |
适应症 |
|
1 |
氢溴酸氘瑞米德韦片 |
上海旺实生物医药科技有限公司 |
化学药品 |
用于新冠病毒感染的治疗。 |
|
2 |
先诺特韦片/利托那韦片组合包装 |
海南先声药业有限公司 |
化学药品 |
用于治疗轻至中度新冠病毒感染(COVID-19)成年患者。 |
|
3 |
盐酸凯普拉生片 |
江苏柯菲平医药股份有限公司 |
化学药品 |
反流性食管炎;十二指肠溃疡。 |
|
4 |
谷美替尼片 |
上海海和药物研究开发股份有限公司 |
化学药品 |
用于治疗具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌。 |
|
5 |
来瑞特韦片 |
广东众生睿创生物科技有限公司 |
化学药品 |
用于治疗轻中度新冠病毒感染(COVID-19)的成年患者。 |
|
6 |
奥磷布韦片 |
南京圣和药业股份有限公司 |
化学药品 |
本品与盐酸达拉他韦联用,治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒(HCV)感染,可合并或不合并代偿性肝硬化。 |
|
7 |
甲磺酸贝福替尼胶囊 |
贝达药业股份有限公司 |
化学药品 |
本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗出现疾病进展,并且伴随EGFRT90M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。 |
|
8 |
伏罗尼布片 |
贝达药业股份有限公司 |
化学药品 |
与依维莫司联合,用于既往接受过酪氨酸激酶抑制剂治疗失败的晚期肾细胞癌(RCC)患者。 |
|
9 |
安奈拉唑钠肠溶片 |
轩竹(北京)医药科技有限公司 |
化学药品 |
用于抑制胃酸,治疗酸相关性疾病,如成人十二指肠溃疡(DU)的治疗及其相关症状(腹痛、腹胀、烧灼感、反酸、嗳气、恶心、呕吐等)控制。 |
|
10 |
伊鲁阿克片 |
齐鲁制药有限公司 |
化学药品 |
适用于既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。 |
|
11 |
磷酸瑞格列汀片 |
江苏恒瑞医药股份有限公司 |
化学药品 |
配合饮食控制和运动,本品单药或与二甲双胍联合用于治疗成人2型糖尿病。 |
|
12 |
奥特康唑胶囊 |
eVENUSPHARMACEUTI CALLABORATORIESINC. |
化学药品 |
本品用于治疗重度外阴阴道假丝酵母菌病(VVC)。 |
|
13 |
培莫沙肽注射液 |
江苏豪森药业集团有限公司 |
化学药品 |
未接受促红细胞生成素治疗的非透析慢性肾病患者的贫血;因慢性肾脏病(CKD)引起贫血,且正在接受促红细胞生成素治疗的透析患者。 |
资料来源:观研天下整理
4、部分创新大品种连续取得突破,市场潜力大
展望未来,我国创新药行业正进入收获期,再加上政策支持力度加大、市场流动性提升以及主要制药厂家纷纷入局,部分创新大品种连续取得突破,以GLP-1为代表的创新大单品畅销全球,我国创新药市场前景光明。
我国创新药企业关注重点领域及现阶段研发进展
|
类别 |
主要靶点/类型 |
国内整体研发上市进度 |
潜在需求人群数 |
|
减重 |
GLP-1R、GLP-1R/GIPR、GLP-1R/GCGR、GLP-1R/AMY3等 |
上市2款(华东医药、仁会生物)、NDA2款(礼来、诺和诺德)、III期临床4项(信达生物、先为达、礼来、诺和诺德)、II期临床10项(石药集团、德睿智药、豪森药业、阳光生物、恒瑞医药、甘李药业、鸿运华宁、博瑞生物、勃林格殷格翰) |
预计2025年达到2.72亿人 |
|
阿尔兹海默症 |
脑-肠轴、Aβ、GLP-1、胆碱酯酶、QPCT、Rac1、NMDA |
等上市1款(绿谷制药)、BLA1款(卫材/渤健)、III期临床4项(礼来、卫材/渤健、诺和诺德、通化金马)、II期临床6项(康弘药业/济生堂、恒清堂、先声药业、康恩贝、卓凯生物、康缘药业、天士力) |
2025年,将有1550万AD患者 |
|
NASH |
PPAR、THR-β、GLP-1、FXR、FGF21等 |
III期临床1项(正大天晴)、II期临床12项(众生药业、歌礼药业、华东医药、正大天晴、拓臻生物、微芯生物、东阳光药、君圣泰生物) |
约5000万人 |
|
自身免疫疾病 |
IL-4R单抗度普利尤单抗,JAK抑制剂乌帕替尼、阿布昔替尼、IL-4R单抗、JAK抑制剂、TSLP单抗、PDE4抑制剂 |
上市3款(赛诺菲、艾伯维、辉瑞)、III期临床4项(恒瑞医药、安进、泽璟制药、康诺亚)、II期临床11项(威凯尔、正大天晴、长森药业、诺诚健华、药捷安康、凌科药业、康乃德、和美药业、恒瑞医药、三生国健、麦济生物) |
2019年中国特应性皮炎患者人数已达到6570万人,其中轻症患者约4750万人,中重症患者约1820万人 |
|
脱发 |
5α-还原酶抑制剂、小分子激素受体激动剂 |
上市6款(三生制药、厦门美商、振东制药、美大康华康、山东京卫、博士伦福瑞达)、NDA1款(三生制药)、III期临床2项(科笛生物、开拓药业) |
脱发人数已超2.5亿人 |
|
乙肝 |
聚乙二醇干扰素、siRNA、ASO、NTCP受体抑制剂、核衣壳抑制剂、HBsAg抑制剂等 |
III期临床4项(科宝生物、凯因科技、东阳光药、孟德尔基因)、II期临床19项(华辉安健、贺普生物、腾盛博药、杨森、GSK、罗氏、齐鲁制药) |
乙肝感染者约为9300万,慢性乙肝患者约2000万 |
资料来源:观研天下整理(WYD)

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。