1、医疗器械行业概述
医疗器械主要指直接或间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关物品,包括各种医用材料、医用设备、医用器具、医用耗材、医用软件等。医疗器械的种类非常广泛,包括医用影像设备、手术器械、康复设备、诊断试剂、口腔医疗器械、眼科医疗器械、心血管医疗器械、呼吸系统医疗器械等。
2、我国医疗器械行业已是全球第二大市场
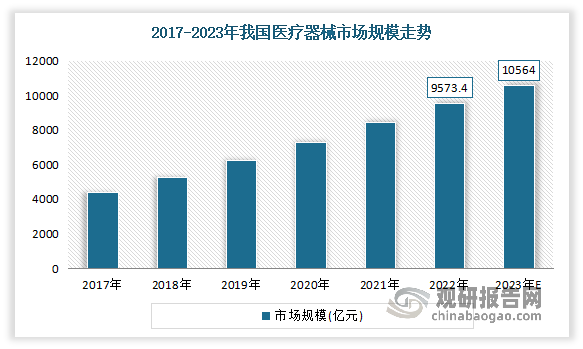
在国内国民生活水平提高、人口老龄化、医疗保障体系不断完善等因素驱动,我国医疗器械市场增长迅速,产业集聚度、国际竞争力不断提升,目前已成为全球第二大市场。根据观研报告网发布的《中国医疗器械行业现状深度研究与发展前景分析报告(2024-2031年)》显示,2022年我国医疗器械市场规模达9573.4亿元,预计2023年我国医疗器械市场规模将达10564亿元。
数据来源:观研天下整理
3、政策端接连发力,国产化成为医疗器械行业主旋律
不过,与发达国家相比,我国医疗器械工业基础薄弱,规模较小,发展较为滞后,尤其是高端医疗装备领域,受国外技术垄断,市场一直严重依赖进口。
医疗器械不同领域核心零部件国产与进口产品对比
|
细分品类 |
核心零部件 |
国产厂家差距 |
|
呼吸机 |
比例阀 |
整体与进口产品仍有差距 |
|
电磁阀 |
/ |
|
|
压缩机 |
/ |
|
|
传感器 |
/ |
|
|
涡轮风机 |
/ |
|
|
芯片 |
/ |
|
|
CT |
球管 |
中低端已掌握,高端仍有较大差距 |
|
探测器 |
联影产品已达到国际水平 |
|
|
高压发生器 |
中低端已掌握,高端差距较小 |
|
|
静音轴承 |
仍有较大差距 |
|
|
滑环 |
仍有较大差距 |
资料来源:观研天下整理
因此,近年来,国产替代一直成为我国医疗器械行业主旋律,政策、资本、创新企业等均在为此奋斗。国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》,对核心技术拥有我国发明专利,产品主要工作原理/作用机理国内首创,具有显著临床应用价值和临床急需等高端医疗器械予以优先审评审批,让这些产品“单独排队,一路快跑”;《“十四五”医疗装备产业发展规划》提出到2025年,医疗装备产业基础高级化、产业链现代化水平明显提升,主流医疗装备基本实现有效供给,高端医疗装备产品性能和质量水平明显提升。
我国医疗器械行业主要政策
|
政策名称 |
主要内容 |
|
《“十四五”医疗装备产业发展规划》 |
推进治疗装备精准化、微创化、快捷化、智能化、可复用化发展。支持具有细分领域技术优势、独特工艺等的专精特新“小巨人”企业,加大研发投入,改进产品性能,巩固竞争优势,加快培育形成一批单项冠军企业和知名品牌。 |
|
《“十四五”规划和2035年远景目标纲要》 |
坚持基本医疗卫生事业公益属性,以提高医疗质量和效率为导向,以公立医疗机构为主体、非公立医疗机构为补充,扩大医疗服务资源供给。推进国家组织药品和耗材集中带量采购使用改革,发展高端医疗设备。完善创新药物、疫苗、医疗器械等快速审评审批机制,加快临床急需和罕见病治疗药品、医疗器械审评审批,促进临床急需境外已上市新药和医疗器械尽快在境内上市。 |
|
《关于进一步促进医疗器械标准化工作高质量发展的意见》(国药监械注〔2021〕21号) |
到2025年,基本建成适应我国医疗器械研制、生产、经营、使用、监督管理等全生命周期管理需要,符合严守安全底线和助推质量高线新要求,与国际接轨、有中国特色、科学先进的医疗器械标准体系,实现标准质量全面提升,标准供给更加优质、及时、多元,标准管理更加健全、高效、协调,标准国际交流合作更加深入、更富成效。 |
|
《深化医药卫生体制改革2020年下半年重点工作任务》 |
开展高值医用耗材集中采购试点;逐步统一全国医保高值医用耗材分类与编码。 |
|
《促进健康产业高质量发展行动纲要(2019-2022年)》 |
将拥有产品核心技术发明专利、具有重大临床价值的创新医疗器械注册申请列入特殊审评审批范围,予以优先办理。修订医疗器械标准,提高医疗器械国际标准的采标率。继续推进高性能医疗器械创新产品应用示范,加大推广力度。 |
|
《治理高值医用耗材改革方案》 |
(1)完善分类集中采购办法,公立医疗机构在采购平台上须公开交易,探索开展集中或者联合带量采购,取消耗材加成,实施零差率;(2)完善临床诊疗规范和指南,加强手术跟台管理,建立院内准入遴选、点评和异常使用预警等机制;(3)完善质量管理,严格注册审批,建立追溯体系和产品质量终身负责制。 |
|
《深化医药卫生体制改革2019年重点工作任务》(国办发〔2019〕28号) |
提出了2019年研究制定的文件,包括制定进一步规范医用耗材使用的政策文件等;推动落实的重点工作,包括制定医疗器械唯一标识系统规则等。 |
|
《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》 |
持续深化药品耗材领域改革,实行高值医用耗材分类集中采购,逐步推行高值医用耗材购销“两票制”。 |
|
《医疗器械标准规划(2018—2020年)》(食药监科〔2018〕9号) |
提出到2020年,建成基本适应医疗器械监管需要的医疗器械标准体系。制修订医疗器械标准300项,标准覆盖面进一步提升,标准有效性、先进性和适用性显著增强的总体目标和主要任务。 |
|
《关于支持社会力量提供多层次多样化医疗服务的意见》 |
推动企业提高创新、研发能力,实现药品医疗器械质量达到或接近国际先进水平,更好支持多层次多样化医疗服务发展;支持自主知识产权药品、医疗器械和其他相关健康产品的研制应用。 |
|
《“十三五”医疗器械科技创新专项规划》 |
加速医疗器械产业整体向创新驱动发展的转型,完善医疗器械研发创新链条;突破一批前沿、共性关键技术和核心部件,开发一批进口依赖度高、临床需求迫切的高端、主流医疗器械和适宜基层的智能化、移动化、网络化产品,推出一批基于国产创新医疗器械产品的应用解决方案。 |
资料来源:观研天下整理
整体从政策细节来分析:第一,国家部门规定国产医疗器械采购比例,政策从医院采购端支持国产。财政部、工信部等部门发布文件,规定政府机构(事业单位)采购国产医疗器械及仪器的比例要求,其中137种医疗器械要求100%采购国产,12种医疗器械要求75%采购国产,24种医疗器械要求50%采购国产,5种医疗器械要求25%采购国产。
同时,在各级地方政府方面,深圳、江苏等诸多地方政府发布支持国产的政策:政府采购应当采购本国货物、工程和服务;确需采购进口产品的,应严格履行审核程序。甚至有地方政府陆续发布通知,要求所有公立医疗机构,未经批准,禁止采购进口产品。
国家关于国产医疗器械行业相关政策
|
层面 |
颁布时间 |
部门 |
文件名 |
主要内容 |
|
国家级 |
2018.08 |
国务院 |
《深化医药卫生体制改革2018年下半年重点工作任务》 |
推进医疗器械国产化,促进创新产品应用推广 |
|
2021.05 |
财政部、工信部 |
《政府采购进口产品审核指导标准(2021年版)》 |
137种医疗器械全部要求100%采购国产;12种医疗器械要求75%采购国产;24种医疗器械要求50%采购国产;5种医疗器械要求25%采购国产 |
|
|
2021.06 |
国家税务总局 |
《研发机构采购国产设备增是谁退税管理办法》 |
符合条件的研发机构采购国产设备,全额退还增值税 |
|
|
地区级 |
2021.02 |
浙江财政厅 |
《2021-2022年度全省政府采购进口产品统一论证清单(医疗设备类)》 |
准入共195种进口产品,相比于2018-2019年度清单减少37种 |
|
2021.04 |
四川财政厅 |
《省级2021-2022年政府采购进口产品清单论证意见公示(医疗卫生设备类)》 |
仅批准59种医疗设备可直接采购进口产品 |
|
|
2021.04 |
广东卫健委 |
《2021年省级卫生健康机构进口产品目录清单》 |
共46种医疗设备纳入进口产品清单,主要由于为国产设备尚不能满足需求,相比2019年,清单种类数量减少了86种 |
|
|
2021.05 |
昆明财政局 |
《关于规范政府采购进口产品核准工作有关事宜的通知》 |
采购进口产品需符合明确条件,并做市场调研报告及专家组论证活动 |
|
|
2021.06 |
陕西卫健委 |
《预算单位政府采购进口产品管理办法》 |
采购进口产品实行单位申报、专家论证(5人以上)、网上公示、部门集中论证、财政审批执行五个环节 |
|
|
2022.04 |
安徽财政厅等 |
《关于规范公立医疗机构政府采购进口产品有关事项的通知》 |
所有公立医疗机构,自2022年6月1日起。未经批准,精致采购进口产品 |
|
|
2022.07 |
深圳发改委等 |
《关于进一步规范政府采购进口产品审核管理的通知》 |
强调政府应该采购本国商品,采购进口产品实行审核管理,统一由行业主管部门进行专家论证和初步审稿 |
资料来源:观研天下整理
第二,政策限定进口产品采购种类。例如,浙江省财政厅发布文件,将可采购进口医疗设备从上一版的215种减少到195种;广东卫健委发布进口产品目录清单,与前两年相比可采购进口的医疗设备数量从132种减少到46种;四川省政府采购网发布公示,仅59种医疗设备可选择进口产品。
第三,创新器械支付机制升级。随着DRG实施,医疗机构的治疗路径发生了转变。国家医保局在《对十三届全国人大五次会议第8013号建议的答复》中指出,指导各地及时将符合条件的创新医用耗材按程序纳入医保支付范围,在推进医保支付方式改革,确定DRG/DIP支付标准等环节,对创新器械等按相关规定和程序予以支持;2023年12月,浙江医保局发布关于公开征求《浙江省创新医药技术医保支付激励管理办法(试行)(征求意见稿)》,明确符合条件的创新药械经申报和认定后,可纳入DRG医保支付激励范围。
创新药械申报审核通过后,医保部门将按本年度DRG清算总额的一定比例确定激励总额,主要对符合适应症要求的病例予以激励;正常或低倍入组病例,按原有规则支付;高倍入组病例或价格较高的创新药械可折算点数支付。激励期限原则上为3年,同时建立退坡激励机制,原则上第一年激励系数为1,第二年激励系数为0.8,第三年激励系数为0.6。医疗机构在鼓励机制下,创新药械入院有望凭借强大的产品优势,及时进入临床使用并加速推广。
创新器械支付方式改革文件
|
时间 |
部门 |
文件 |
内容 |
|
2022年 |
国家医保局 |
《对十三届全国人大五次会议第8013号建议的答复》 |
正研究完善相关政策,指导各地及时将符合条件的创新医用耗材按程序纳入医保支付范围;推进医保支付方式改革,确定按疾病诊断相关分组(CHS-DRG)、按病种分值付费(DIP)支付标准等环节,对创新医用耗材等按相关规定和程序予以支持。 |
|
2022年 |
北京医保局 |
《关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》 |
试行CHS-DRG付费新药新技术除外支付管理办法。 |
|
2023年 |
北京医保局 |
《关于印发2023年北京市医疗保障重点工作的通知》 |
明确提出持续深化多元复合式医保支付方式改革。完善新药新技术和特殊病例除外处理机制,深化DRG付费和带量采购政策联动管理。 |
|
2023年 |
上海医保局 |
《上海市进一步完善多元支付机制支持创新药械发展的若干措施》 |
在DRG/DIP支付方面对创新药械予以倾斜,提高新技术应用病例支付标准,新技术应用高倍率病例不设控制比例,成规模新技术应用可独立成组。稳步扩大本市医疗服务项目和医用耗材医保支付范围,优先覆盖创新药械。 |
资料来源:观研天下整理
4、我国医疗器械行业迎来黄金发展期,国产化进程加快
在多项国家政策支持下,我国医疗器械行业迎来黄金发展期,其中冠脉支架、药物球囊、骨科植入物、吻合器、医用影像设备、生化试剂等领域产品完成国产替代,相关产品国产化率超50%。同时,国产企业在多个高端医疗器械领域开始围攻跨国品牌,如东软、联影、宽腾、明峰等国产品牌的医学影像设备开始抢占GE医疗、飞利浦医疗、西门子医疗的市场份额,微创机器人、精锋医疗、思哲睿等中国企业开始与达芬奇手术机器人打起价格战……
随着我国医疗器械行业国产替代加速加快,部分外资企业选择退出中国市场,如骨科巨头ZimVie于2023年3月宣布将旗下脊柱业务完全撤出中国市场;有的则选择实施本土化战略,如影像三巨头“GPS”高举本土化旗帜,以国产身份参与市场竞争。而有些外资企业在中国建立生产基地,以国产身份参与市场竞争。例如,美敦力、强生、波科、奥林巴斯、“GPS”等世界级器械企业均在中国已经或计划建设生产基地。(WYD)

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。