一、仿制药行业概述及种类
仿制药是指与商品名药在剂量、安全性和效力(strength)(不管如何服用)、质量、作用(performance)以及适应症(intended use)上相同的一种仿制品(copy)。
仿制药主要可分为化学仿制药和生物类似药,其中化学仿制药指用化学合成的方法生产专利失效的药品,通常属于小分子化学药,有效成分和参照药完全一致。

资料来源:公开资料、观研天下整理
二、我国仿制药市场规模
我国是仿制药大国,近些年来,随着国家政策对药品持续规范化,对药品质量要求提高,大批劣质仿制药将被淘汰,仿制药市场正在逐渐重塑。数据显示,在2021年我国仿制药市场规模达到了9069亿元,同比增长7.4%。

资料来源:观研天下整理
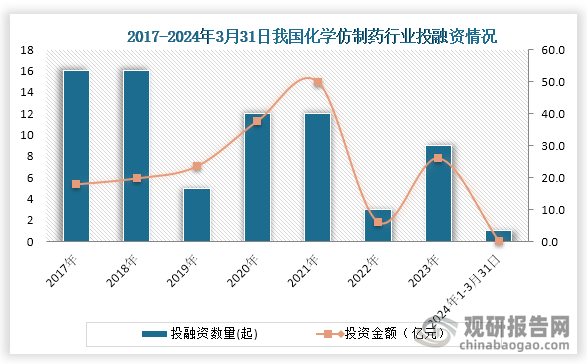
三、我国化学仿制药融资情况
从化学仿制药融资情况来看,2021年我国化学仿制药投融资金额达到顶峰,金额为49.95亿元,2022年下降,到2023年回升,投融资金额为26.12亿元。2024年1-3月发生1起投融资事件,金额为0.3亿元。
资料来源:IT桔子、观研天下整理
四、我国仿制药行业相关企业情况
我国仿制药相关上市企业主要有美迪西 (688202)、景峰医药 (000908)、阳光诺和 (688621)、万邦医药 (301520)和百诚医药 (301096)等。
我国仿制药行业相关上市企业情况
|
企业简称 |
上市时间 |
竞争优势 |
|
美迪西 (688202) |
2019-11-05 |
人才优势:公司各业务板块主要管理人员均具有医药研发领域超过10年的研究管理经验,对行业有非常丰富的经验和深刻的理解,确保公司规模化、高质量地向客户提供医药研发服务。 |
|
业务优势:公司已帮助客户完成数个抗体及抗体药物偶联物(ADC)的整套临床前研究,其中10件ADC药物的药代和安全性评价研究已通过NMPA技术审评并进入临床试验阶段。 |
||
|
景峰医药 (000908) |
1999-02-03 |
规模优势:现拥有22家全资、控股子公司分布在上海、贵州、辽宁、江苏和海南等地。 |
|
资质优势:荣获“2016年中国医药工业百强”、“2016年中国制药工业百强”、“2016中国制造业上市公司创造价值百强”、“2017中国最具影响力医药企业百强” 等荣誉称号。 |
||
|
阳光诺和 (688621) |
2021-06-21 |
技术优势:2015年以来,公司参与研发的项目已累计取得147项药品临床批件或临床备案号;1项创新药进入Ⅲ期临床试验,且为“国家重大科技专项-重大新药创制专项”,另有1项创新药进入Ⅱ期临床试验;已取得95项药品上市注册受理号,已有6项仿制药首家取得药品注册批件或首家通过一致性评价。 |
|
研发优势:公司拥有的“临床前+临床”综合研发服务模式竞争优势比较明显,为客户提供一体化的一站式服务逐步成为CRO公司构建自身竞争力、提升客户粘性、拓展业务范围、保障盈利能力的有效途径。 |
||
|
万邦医药 (301520) |
2023-09-25 |
资质优势:公司自成立以来,荣获了国家高新技术企业、中国医药外包公司20强、中国医药守法诚信企业、合肥高新区瞪羚企业、安徽省企业技术中心、安徽省专精特新中小企业等多个荣誉。 |
|
团队优势:公司管理团队拥有多年的CRO行业经验,具有扎实的理论功底和良好的专业判断能力。 |
||
|
百诚医药 (301096) |
2021-12-20 |
研发优势:公司拥有多种研发技术平台,包括创新中心(AI设计、生物芯片、动物实验)、API研究中心(管式、微通反应、酶法)、药学中心(雾化吸入、透皮给药、脂质体、缓控释、细粒掩味、杂质研究、分析测试)、临床中心(生物样本检测、数据统计)等技术平台。 |
|
业务优势:全方位合作高等院校、科研院所、研发团队、制药企业、MAH公司、投资资本,打造医药产业新生态,已为500多家客户提供研发服务800余项,实现共融、共享、共发展。 |
资料来源:公司资料、观研天下整理
五、我国仿制药行业政策
仿制药是我国医药市场的重要组成部分,为推动仿制药行业的发展,我国及部分省市发布了多项行业政策,如2023年中共中央、国务院发布的《质量强国建设纲要》提出加强药品和疫苗全生命周期管理,推动临床急需和罕见病治疗药品、医疗器械审评审批提速,提高药品检验检测和生物制品(疫苗)批签发能力,优化中药审评机制,加速推进化学原料药、中药技术研发和质量标准升级,提升仿制药与原研药、专利药的质量和疗效一致性。
我国及部分省市仿制药行业相关政策
| 层级 | 发布时间 | 发布部门 | 政策名称 | 主要内容 |
| 国家级 | 2022年4月 | 国务院办公厅 | “十四五”国民健康规划 | 完善国家药品标准体系,推进仿制药质量和疗效一致性评价。 |
| 国家级 | 2023年2月 | 中共中央、国务院 | 质量强国建设纲要 | 加强药品和疫苗全生命周期管理,推动临床急需和罕见病治疗药品、医疗器械审评审批提速,提高药品检验检测和生物制品(疫苗)批签发能力,优化中药审评机制,加速推进化学原料药、中药技术研发和质量标准升级,提升仿制药与原研药、专利药的质量和疗效一致性。 |
| 省级 | 2023年5月 | 广西壮族自治区 | 广西贯彻落实〈质量强国建设纲要〉实施方案 | 加速推进化学原料药、中药技术研发和质量标准升级,提升仿制药与原研药、专利药的质量和疗效一致性,加快建设防城港国际医学开放试验区。 |
| 省级 | 2023年7月 | 江西省 | 江西省制造业重点产业链现代化建设“1269”行动计划(2023-2026年) | 引导支持原料药绿色生产基地建设,鼓励企业开展仿制药一致性评价,提高现有品种的市场竞争力和临床认可度,结合开展仿制药一致性评价和配套的采购使用政策,在保障药品供应的前提下实现仿制药生产集中度提高。 |
| 省级 | 2023年7月 | 河北省 | 关于支持生物医药产业高质量发展的若干措施 | 支持创新药、仿制药产业化。对获得药品注册证书的创新药、改良型新药以及其他新获得药品注册证书的仿制药,且在省内落地的产业化项目,择优纳入省高技术产业化项目计划,分别给予不超过项目总投资30%、20%、15%,最高5000万元、2000万元、1000万元的资金补助。 |
| 省级 | 2023年12月 | 云南省 | 云南省深化医药卫生体制改革近期重点工作任务 | 加大对国家集采政策和仿制药一致性评价知识的宣传解读。 |
| 市级 | 2023年12月 | 成都市 | 深入推进质量强市建设推动高质量发展实施方案 | 依法加强药品、疫苗质量安全监管,推动仿制药一致性评价工作。 |
资料来源:观研天下整理(XD)
观研天下®专注行业分析十一年,专业提供各行业涵盖现状解读、竞争分析、前景研判、趋势展望、策略建议等内容的研究报告。更多本行业研究详见《中国仿制药行业现状深度研究与投资前景分析报告(2024-2031年)》。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。